题目内容
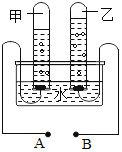
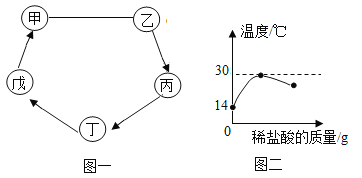
【题目】甲、乙、丙、丁、戊、己六种初中化学常见的物质都是由C、H、O、Na、Ca中的元素组成,其中甲~戊是由两种或三种元素组成的化合物,己是非金属固体单质,甲和乙是常用的灭火剂,丁可发生中和反应。它们转化关系如图一所示(反应条件、部分反应物或生成物略去)。
(1)物质乙的化学式为_____。
(2)生成物质丁的化学方程式为_____。
(3)下列物质既能与丙又能与戊发生化学反应的是_____(填序号)。
A 锌 B 稀硫酸 C 氧化铁 D 氯化钡
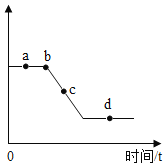
(4)室温下,将稀盐酸慢慢滴入盛有丁溶液的烧杯中,溶液温度随加入盐酸的质量而变化的曲线如图二所示。
①请解释ab段温度变化的原因_____。
②表示恰好完全反应的点是_____。
(5)现有物质己与氧化铜两种粉末的混合物30g,其中氧元素的质量分数为19%,放入带有气体导管的大试管中,高温加热该混合物一段时间后,产生4.4g二氧化碳,则剩余固体中氧元素的质量分数是_____(计算结果保留至0.1%)。
【答案】H2O Ca(OH)2+Na2CO3=CaCO3↓+2NaOH B 氢氧化钠和盐酸发生中和反应,放出热量 b 9.8%
【解析】
甲、乙、丙、丁、戊、己六种初中化学常见的物质都是由C、H、O、Na、Ca中的元素组成,其中甲~戊是由两种或三种元素组成的化合物,己是非金属固体单质,所以己是碳,甲和乙是常用的灭火剂,丁可发生中和反应,所以丁是酸或碱,丙应该是盐、酸或碱,所以乙是水,甲是二氧化碳,水可以转化成丙,所以丙是氢氧化钙,丁可以是氢氧化钠,戊是碳酸钠,碳酸钠可以转化成二氧化碳,经过验证,推导正确。
(1)由分析可得,物质乙的化学式为:H2O;故填:H2O。
(2)生成物质丁的反应是氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,化学方程式为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;故填:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH。
(3)既能与氢氧化钙,又能与碳酸钠发生化学反应的是稀硫酸,故填:B。
(4)室温下,将稀盐酸慢慢滴入盛有氢氧化钠溶液的烧杯中,氢氧化钠和盐酸反应放出热量,所以①ab段温度变化的原因:氢氧化钠和盐酸发生中和反应,放出热量;②表示恰好完全反应的点是:b,温度达到了最高点;故填:氢氧化钠和盐酸发生中和反应,放出热量;b。
(5)现有物质碳与氧化铜两种粉末的混合物30g,其中氧元素的质量分数为19%,混合物中氧元素的质量为:30g×19%=5.7g,二氧化碳中氧元素的质量为:![]() ,剩余氧元素的质量为:5.7g﹣3.2g=2.5g。
,剩余氧元素的质量为:5.7g﹣3.2g=2.5g。
剩余固体中氧元素的质量分数为:![]() 。故填:9.8%。
。故填:9.8%。

 走进文言文系列答案
走进文言文系列答案【题目】除去下列物质中的少量杂质,所选用的试剂和操作方法都是正确的是( )
选项 | 物质 | 杂质 | 试剂及操作方法 |
A | 稀盐酸 | 稀硝酸 | 加入适量的硝酸银溶液,过滤 |
B | 二氧化锰 | 氯化钾 | 加入适量的水,溶解、过滤、蒸发、结晶 |
C | 硫酸钠溶液 | 硫酸 | 加入适量的氢氧化钡溶液,过滤 |
D | 氯化钠溶液 | 氢氧化钠 | 加入适量稀盐酸至 |
A.AB.BC.CD.D