题目内容
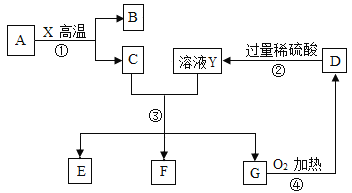
【题目】如图是电解水的实验装置图,填空:
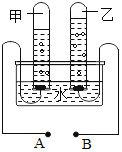
(1)A为_______极;
(2)甲管与乙管中产生的气体体积比约是_______;
(3)该实验中往往要在水中滴入氢氧化钠溶液,其目的是_______;
(4)若将质量分数为1%的NaOH溶液100g进行电解,当溶液中NaOH 的质量分数升高到2%时停止电解,则生成的H2的质量为_______g(结果保留1位小数)。
【答案】负 2:1 增强水的导电性 5.6
【解析】
(1)由电解水的实验装置图可知,甲试管收集的气体较多是氢气,所连接A为负极;
(2)由电解水的实验装置图可知,甲管与乙管中产生的气体体积比约是2:1;
(3)由于氢氧化钠在水中能解离出自由移动的离子,所以该实验中往往要在水中滴入氢氧化钠溶液,其目的是增强水的导电性;
(4)设分解水的质量为x,100g×1%=(100g﹣x)×2%,x=50g;则生成的H2的质量为:50g×![]() ×100%≈5.6g。
×100%≈5.6g。

练习册系列答案
 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
【题目】如表是国家对“饮酒驾车”和“醉酒驾车”的界定标准。
饮酒驾车 | 20mg/100mL≤血液中的酒精含量<80mg/100mL |
醉酒驾车 | 血液中的酒精合量≥80mg/100mL |
白酒、酒精和啤酒中均含有乙醇(俗称酒精,化学式为C2H5OH),饮酒后酒精可进入人体血液中。回答下列问题:
(1)乙醇分子中碳、氢、氧各原子个数比为_______,其中碳、氢元素的质量比是_______;
(2)乙醇中碳元素的质量分数为_______。(结果精确到0.1%)。
(3)饮酒会使人的神经系统过度兴奋或麻痹抑制,容易引发交通事故。某人饮酒后驾 车,被交警发现,经测定其每10mL血液中酒精含量为9.3mg,属于_______驾车。