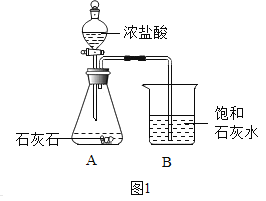
题目内容
【题目】已知,标准状况下二氧化碳的密度可表示为44/22.4g/L。将CO2通入NaOH溶液中,所得产物随通入的CO2的质量的不同而不同。完成下列填空。
(1)向NaOH溶液中通入CO2,先发生反应_____(用方程式表示),继续通入,又发生反应_____。
(2)250g质量分数4%的NaOH溶液,最多可吸收CO2的体积为_____L(标准状况下)。
(3)向250质量分数8%的的NaOH溶液中通入一定量CO2,溶液增重4.4g,将所得溶液蒸干,计算所得固体中各成分以及其质量为_____。
(4)向未知浓度、体积为VL的NaOH溶液中缓缓通入一定体积(标准状况下)的CO2,充分反应后,CO2和NaOH均无剩余,再向溶液中加入过量的澄清石灰水生成m1g白色沉淀。根据以上数据,用代数式表示CO2的体积V(CO2)=_____。
【答案】![]()
![]() 5.6L NaOH 12g Na2CO3 10.6g 0.224m1L
5.6L NaOH 12g Na2CO3 10.6g 0.224m1L
【解析】
(1)向NaOH溶液中通入CO2,氢氧化钠先与二氧化碳反应生成碳酸钠和水,该反应的化学方程式为:![]() ,继续通入二氧化碳,碳酸钠会与二氧化碳、水反应生成碳酸氢钠,该反应的化学方程式为:
,继续通入二氧化碳,碳酸钠会与二氧化碳、水反应生成碳酸氢钠,该反应的化学方程式为:![]() ;
;
(2)当二氧化碳不足时,发生的反应:![]() ,当二氧化碳过量时,发生的反应:
,当二氧化碳过量时,发生的反应:![]() ,
,![]() ,二氧化碳过量时,该反应的总方程式为:
,二氧化碳过量时,该反应的总方程式为:![]() ;由化学方程式可知,二氧化碳过量时,参加反应的氢氧化钠与二氧化碳的质量比为:40:44,二氧化碳不足时,参加反应的氢氧化钠与二氧化碳的质量比为:80:44,故二氧化碳过量时,吸收二氧化碳的质量最大,设最多可吸收CO2的体积为x
;由化学方程式可知,二氧化碳过量时,参加反应的氢氧化钠与二氧化碳的质量比为:40:44,二氧化碳不足时,参加反应的氢氧化钠与二氧化碳的质量比为:80:44,故二氧化碳过量时,吸收二氧化碳的质量最大,设最多可吸收CO2的体积为x

![]() x=5.6L
x=5.6L
(3)向250g质量分数8%的的NaOH溶液中通入一定量CO2,溶液增重4.4g,增加的质量就是参加反应的二氧化碳的质量,![]() ,参加反应的氢氧化钠与二氧化碳的质量比为:80:44,设250g质量分数8%的的NaOH溶液完全反应,吸收二氧化碳的质量为x,80:44=(250g×8%):x,x=11g>4.4g,故氢氧化钠过量,将所得溶液蒸干,所得固体为碳酸钠和氢氧化钠的混合物,设参加反应的氢氧化钠的质量为m,生成碳酸钠的质量为n
,参加反应的氢氧化钠与二氧化碳的质量比为:80:44,设250g质量分数8%的的NaOH溶液完全反应,吸收二氧化碳的质量为x,80:44=(250g×8%):x,x=11g>4.4g,故氢氧化钠过量,将所得溶液蒸干,所得固体为碳酸钠和氢氧化钠的混合物,设参加反应的氢氧化钠的质量为m,生成碳酸钠的质量为n
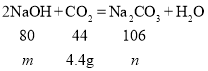
![]() m=8g
m=8g
![]() n=10.6g
n=10.6g
所得固体中氢氧化钠的质量为:250g×8%-8g=12g
碳酸钠的质量为10.6g;
(4)向未知浓度、体积为VL的NaOH溶液中缓缓通入一定体积(标准状况下)的CO2,充分反应后,CO2和NaOH均无剩余,再向溶液中加入过量的澄清石灰水生成m1g白色沉淀,可能发生的反应为:![]() ,
,![]() ,
,![]() ,
,![]() ,由化学方程式可知,生成的白色沉淀是碳酸钙,二氧化碳中的碳元素全部转到了碳酸钙中,根据质量守恒定律,化学反应前后,元素的质量不变,碳酸钙中碳元素的质量为:
,由化学方程式可知,生成的白色沉淀是碳酸钙,二氧化碳中的碳元素全部转到了碳酸钙中,根据质量守恒定律,化学反应前后,元素的质量不变,碳酸钙中碳元素的质量为:![]() ,通入二氧化碳的质量为:
,通入二氧化碳的质量为:![]() ,通入二氧化碳的体积为:
,通入二氧化碳的体积为:![]() 。
。

 名题训练系列答案
名题训练系列答案 期末集结号系列答案
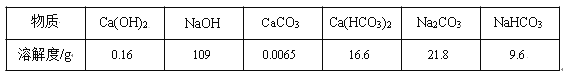
期末集结号系列答案【题目】某些盐在溶液中结晶时,析出的晶体是结晶水合物。下表记录了t°C时向4份相同的硫酸铜溶液中加入的无水硫酸铜的质量以及析出硫酸铜晶体(CuSO4·5H2O)的质量的实验数据:
硫酸铜溶液 | Ⅰ | Ⅱ | III | IV |
加入的无水硫酸铜(g) | 2.5 | 4.0 | 6.0 | 8.0 |
析出的硫酸铜晶体(g) | 0.10 | 2.8 | 6.4 | 10.0 |
当加入4.6g无水硫酸铜时,析出硫酸铜晶体的质量为( )
A.2.56gB.3.42g
C.3.88gD.6.82g
【题目】一包白色粉末A由Na2SO4、NaOH、Ba(OH)2、BaCO3、 MgC12五种物质中的两种或多种混合而成。为探究其组成,进行如下图所示的实验: (假设 实验过程中所发生的反应均恰好完全反应)
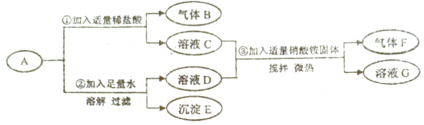
依据实验过程和出现的现象请你回答下列问题:
(1)气体F的化学式是_______。
(2)写出步骤①中生成气体B的化学方程式:______。
(3)在溶液C和溶液G中,一定都存在的阴离子是_____(写离子符号)。
(4)固体混合物A中,肯定不存在的物质有______种。若要进一步推理A的组成,可用溶液D再做实验确定可能含有的物质:
实验操作 | 实验现象 | 实验结论 |
取溶液D少许,滴加Na2SO4溶液,震荡 | 有白色沉淀生成 | ______ |