题目内容
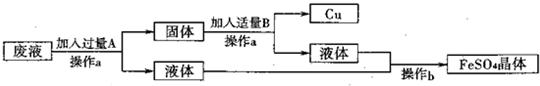
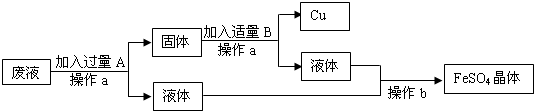
19、某工厂欲从只含有CuSO4的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如下:

(1)操作a、b的名称分别是
(2)写出流程中有关反应的化学方程式:

(1)操作a、b的名称分别是
过滤,蒸发
.(2)写出流程中有关反应的化学方程式:
Fe+CuSO4=FeSO4+Cu
、Fe+H2SO4=FeSO4+H2↑
.以上两个反应能够发生的原因是在金属活动顺序中,铁位于铜,氢之前
.分析:在金属活动性顺序中,氢前的金属能与酸反应生成盐和氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,故要回收铜得到硫酸亚铁,可以加入铁.
解答:解:(1)经过操作a能得到固体和液体,故a操作为过滤,从液体中得到晶体可以是蒸发操作,所以本题答案为:过滤,蒸发;
(2)经过操作a得到的液体中能得到硫酸亚铁,说明回收铜时加入的是铁,多余的铁与硫酸反应生成硫酸亚铁,
故答案为:Fe+CuSO4=FeSO4+Cu,Fe+H2SO4=FeSO4+H2↑
(2)经过操作a得到的液体中能得到硫酸亚铁,说明回收铜时加入的是铁,多余的铁与硫酸反应生成硫酸亚铁,
故答案为:Fe+CuSO4=FeSO4+Cu,Fe+H2SO4=FeSO4+H2↑
点评:本题考查了铜的回收,完成此题,可以依据金属活动性顺序及其意义进行.

练习册系列答案
相关题目