题目内容
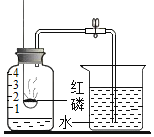
【题目】同学甲用排水集气法收集到几瓶无色气体,
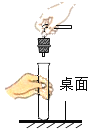
(1)如图所示放置,请你推测该气体除颜色、状态以外的其他一些物理性质:___
![]()
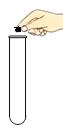
(2)同学乙确定这是氧气,检验方法_____
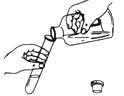
(3)同学甲做了红磷和铁丝的性质实验,写出红磷燃烧的化学方程式_____,写出铁丝燃烧的现象:_____。
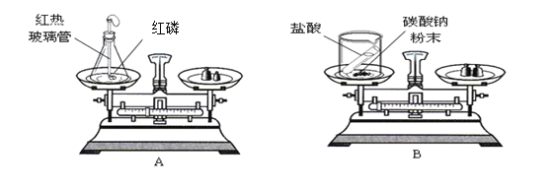
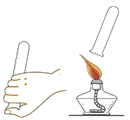
(4)乙同学为了证明质量守恒定律,点燃1g光亮镁条。反应结束后,仔细收集白色粉末称量,根据质量守恒定律,理论上应该大于1g,原因_____。乙同学实际称白色粉木小于1g,分析可能的原因_____ (不考虑误差)
(5)用加热氯酸钾和二氧化锰的混合物制取氧气,若加热反应结束产生氧气0.06mol则分解的氯酸钾的质量是多少克?(列式计算)______
【答案】密度比空气大 用带火星的木条插入集气瓶内,木条复燃 4P+5O2![]() 2P2O5 铁丝剧烈燃烧,火星四射,放出大量的热,生成黑色固体 镁条燃烧是与空气中的氧气反应生成的氧化镁 生成的白烟跑掉了一部分 4.9g
2P2O5 铁丝剧烈燃烧,火星四射,放出大量的热,生成黑色固体 镁条燃烧是与空气中的氧气反应生成的氧化镁 生成的白烟跑掉了一部分 4.9g
【解析】
(1)如图所示放置,由于瓶口向上,所以对应的物理性质:密度比空气大;
(2)同学乙确定这是氧气,由于氧气支持燃烧,所以检验方法用带火星的木条插入集气瓶内,木条复燃;
(3)同学甲做了红磷和铁丝的性质实验,红磷燃烧是红磷和氧气在点燃的条件下生成五氧化二磷,对应的化学方程式 4P+5O2![]() 2P2O5,铁丝燃烧的现象:铁丝剧烈燃烧,火星四射,放出大量的热,生成黑色固体;
2P2O5,铁丝燃烧的现象:铁丝剧烈燃烧,火星四射,放出大量的热,生成黑色固体;
(4)乙同学为了证明质量守恒定律,点燃1g光亮镁条。反应结束后,仔细收集白色粉末称量,根据质量守恒定律,理论上应该大于1g,原因镁条燃烧是与空气中的氧气反应生成的氧化镁。乙同学实际称白色粉木小于1g,分析可能的原因 生成的白烟跑掉了一部分 (不考虑误差);
(5)设分解的氯酸钾的质量为x。
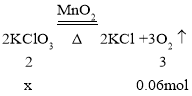
![]() x=0.04mol;
x=0.04mol;
分解的氯酸钾的质量=122.5g/mol×0.04mol=4.9g。

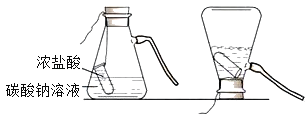
【题目】某实验小组的同学用碳酸钠粉末、碳酸钙粉末、块状大理石、稀盐酸、浓盐酸、稀硫酸这几种药品,探究哪些药品适合在实验室制取CO2.请你参与下列的探究并回答问题.
(提出问题)上述哪些物质间的反应适合在实验室制取CO2?
(方案设计)大家经过讨论,一致认为浓盐酸不适合用于实验室制取CO2,你认为原因是_____;讨论后大家设计了如下四个实验进行对比分析.
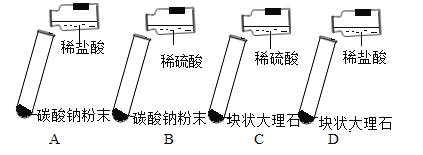
(实验与结论)
(1)请你填写实验报告中①、②处的内容.
实验 | 实验现象 | 实验内容 |
A | 剧烈反应,迅速放出大量气泡 | 反应速率过快,气体不便收集 |
B | 剧烈反应,迅速放出大量气泡 | 反应速率过快,气体不便收集 |
C | 产生气泡,速率迅速减慢,反应几乎停止 | 无法持续产生CO2 |
D | ①_____ | ②_____ |
(2)根据探究结论,实验室制取二氧化碳的药品是_____和_____,反应原理为_____ ( 用化学方程式表示);
(拓展与迁移)
(1)由上述探究可知,在确定实验室制取气体的反应原理时,要考虑诸多因素,例如反应速率要适中,便于收集等.请你再写出一种需要考虑的因素:_____;
(2)如图是一种灭火器的工作原理示意图,其中用碳酸钠和浓盐酸反应来产生CO2的理由是_____.