题目内容
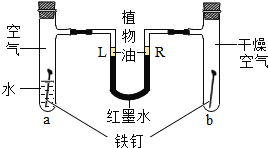
【题目】如图是测定空气中氧气含量的实验.
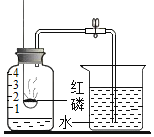
(1)将燃烧匙内过量的红磷点燃,迅速伸入集气瓶内,观察到的主要现象是_____,该反应的化学方程式为_____,基本反应类型_____;
(2)红磷燃烧一段时间后,自动熄灭了,你认为原因是:_____;
(3)_____冷却后,打开止水夹,观察到的现象为_____,由此可得出的结论是_____,
(4)该实验还可说明氮气具有的化学性质是(写一条即可)_____.
【答案】产生大量白烟 4P+5O2![]() 2P2O5 化合反应 集气瓶内的氧气已消耗完 集气瓶 烧杯中的水进入集气瓶,集气瓶内水面上升约五分之一 氧气约占空气体积的
2P2O5 化合反应 集气瓶内的氧气已消耗完 集气瓶 烧杯中的水进入集气瓶,集气瓶内水面上升约五分之一 氧气约占空气体积的![]() 不燃烧,不支持燃烧
不燃烧,不支持燃烧
【解析】
(1)点燃燃烧匙中的红磷,立即伸入集气瓶中并把塞子塞紧,观察到红磷燃烧的现象是产生大量白烟;红磷燃烧生成五氧化二磷,反应的化学方程式为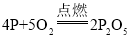 ,属于化合反应。
,属于化合反应。
(2)红磷熄灭的主要原因是瓶内的氧气被消耗完,没有支持红磷燃烧的物质了。
(3)红磷在密闭容器内燃烧消耗了装置内的氧气,使装置内气体气体减少,造成压强减小,待集气瓶冷却到室温,打开止水夹,观察到的现象是烧杯中的水进入集气瓶,集气瓶内水面上升约五分之一,由此可得出的结论是氧气约占空气体积的![]() 。
。
(4)集气瓶内水面上升约五分之一,水面不再继续上升,说明氮气不易溶于水,不燃烧,不支持燃烧.

 53随堂测系列答案
53随堂测系列答案【题目】(提出问题)氧化铁能否作过氧化氢溶液分解的催化剂?其催化效果如何?
(实验探究)
实验步骤 | 实验现象 |
I.分别量取5mL5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入ag氧化铁粉末,并分别在A、B两支试管中插入带火星木条,观察现象。 | A试管中产生气泡,带火星木条复燃,B试管中无明显现象。 |
II.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次试验,观察现象。 | 试管中均产生气泡,带火星木条均复燃 |
III.将实验II中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为ag。 | |
IV分别量取5mL5%过氧化氢溶液放入C、D 两支试管中,向C试管中加入ag氧化铁粉末,向D试管中加入ag二氧化锰粉末,观察现象。 |
(实验结论)
(1)实验I证明:氧化铁_____(“能”或“否”)改变过氧化氢分解反应的速率;
(2)实验II、III证明:氧化铁的_____和_____在反应前后均没有发生变化,可以作过氧化氢分解的_____;
(3)写出氧化铁催化过氧化氢分解的符号表达式_____。
(实验评价)(1)实验设计IV的目的是_____;
(2)若实验IV观察到D试管中产生气泡的速率更快,由此你可以得到的结论是_____。
(3)在催化剂相同条件下,如何提高过氧化氢的分解速率?请设计实验方案:_____。