题目内容
街头上有许多便宜的“黄金”饰品出售,实际上它们不是黄金,而是铜锌合金,因其具有较好的机械性能和光泽度,所以常被做成饰品.现取30g该合金样品,投入到196g某浓度的稀硫酸中,恰好完全反应后,剩余的溶液和残余固体总质量为225.6g.请计算:
(1)产生氢气的质量为 g
(2)剩余溶液中溶质的质量分数是多少?(结果保留到1%).
(1)0.4 ;(2)剩余溶液中溶质的质量分数是15% .
解析试题分析:(1)由质量守恒定律可知生成的氢气的质量为:30g+196g-225.6g=0.4g
(2)根据锌与硫酸反应的方程式,由氢气的质量求出硫酸锌的质量,再结合质量守恒定律及溶质质量分数的计算公式求出剩余溶液中溶质的质量分数:
设参加反应的锌的质量为x,生成的硫酸锌的质量为y
Zn+H2SO4═ZnSO4+H2↑
65 161 2
x y 0.4g =
=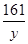 =
=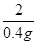
解得:x=13g y=32.2g
剩余溶液中溶质的质量分数是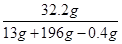 ×100%=15%
×100%=15%
答:(1)0.4;(2)剩余溶液中溶质的质量分数是15%.
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算

练习册系列答案
相关题目
如下图所示,实验室用过氧化氢溶液和二氧化锰制取氧气,实验的相关数据如下表。
| | 气体发生装置内物质的总质量 |
| 反应前 | 35.6 |
| 反应后 | 34.8 |
(l)反应中二氧化锰的作用是 。
(2)反应生成氧气的质量为 g(结果精确到0. 1 g,下同)。
(3)计算参加反应的过氧化氢的质量,写出必要的计算过程。