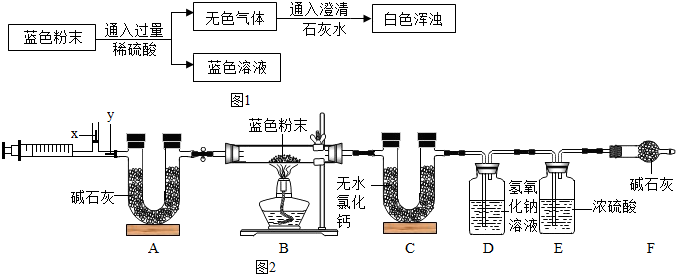
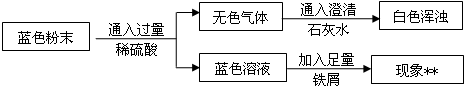
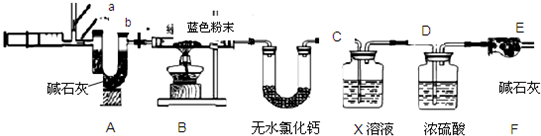
题目内容
将过量的Na2CO3溶液滴入到一定量CuSO4溶液中得到蓝色固体.某研究性学习小组对固体沉淀的成分进行了如下探究.请完成下列各题:(一)猜想与假设:
猜想一:固体为CuCO3,理由:______(用化学反应方程式表示).
猜想二:固体为Cu(OH)2,理由:Na2CO3溶液呈______(填“酸”或“碱”)性.
猜想三:固体为Cu(OH)2和CuCO3的混合物.
(二)资料查阅:
①结晶水合物受热后易失去结晶水,如CuSO4?5H2O
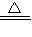 CuSO4+5H2O↑;
CuSO4+5H2O↑;②Cu(OH)2、CuCO3受热易分解,各生成对应的两种氧化物.
③无水氯化钙可做吸水剂;碱石灰的主要成分为氢氧化钠固体和氧化钙
(三)设计与实验:
Ⅰ.固体的获取:
(1)将反应后的固、液混合物经______、洗涤、室温晾干得蓝色固体.
Ⅱ.用下图所示方案,初步定性探究固体的成分.

(2)无色气体为______
(3)加入足量铁屑发生反应的方程式为______、______
结论:猜想______不成立.
Ⅲ.固体组成定量测定:
设固体为aCu(OH)2?bCuCO3?cH2O,为测定其组成,称取24.0g蓝色固体.继续进行实验:
【实验步骤】
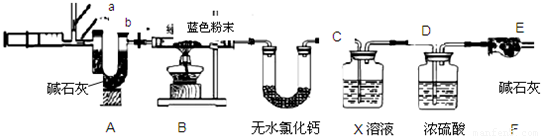
图中注射器处为两个单向阀:推注射器时a关闭,b处打开;拉注射器时,a打开进空气,b关闭.
实验步骤 ①组装好装置,检查气密性;②反复推拉注射器;③称量B、C、D、E、F的质量;④关闭弹簧夹,加热B处试管直到反应不再进行;⑤打开弹簧夹,再次反复缓缓推拉注射器;⑥再次称量B、C、D、E、F的质量.
问题探究:
(4)写出Cu(OH)2、CuCO3分解的化学方程式______ CuO+H2O↑
【答案】分析:(一)猜想与假设:根据方程式的书写和碳酸钠的碱性考虑;(三)设计与实验:Ⅰ:根据不溶于液体的固体和液体分离的方法考虑;Ⅱ.根据方程式的写法和二氧化碳的性质考虑;(4)根据方程式的书写方法和生成物来判断;(5)根据D中药品是用来吸收二氧化碳的考虑;(6)根据步骤⑤的操作目的和推注射器目的考虑;(7)根据E中液体的性质和方程式进行计算考虑;(8)根据反应前后原子种类和个数不变考虑.
解答:解:(一)猜想与假设:反应物是硫酸铜和碳酸钠,生成物是碳酸铜沉淀和硫酸钠;碳酸钠虽然属于盐但是显碱性,俗称为纯碱;
(三)设计与实验:(1)不溶于液体的固体和液体分离的方法是过滤;(2)由于二氧化碳能使澄清石灰水变浑浊,所以无色气体是二氧化碳;
(3)由于加入的硫酸是过量的,所以加入铁后,铁与硫酸反应生成硫酸亚铁和氢气,氢气后面标上上升符号;由于前面加入硫酸后生成了硫酸铜,所以加入铁后,铁与硫酸铜反应生成铜和硫酸亚铁;因为加入硫酸后产生气体,说明其中需要含有碳酸根离子,而猜想二中没有碳酸根,所以不成立;
(4)根据Cu(OH)2、CuCO3受热易分解,各生成对应的两种氧化物,所以氢氧化铜分解的生成物是氧化铜和水,反应条件是加热;碳酸铜分解后生成氧化铜和二氧化碳,二氧化碳后面标上上升符号,反应条件是加热;根据氢氧化铜和碳酸铜受热分解的生成物,可知aCu(OH)2?bCuCO3?cH2O分解的生成物是氧化铜、水、二氧化碳;用观察法配平,二氧化碳后面标上上升符号;
(5)因为D中的药品主要是用来吸收二氧化碳的,由于二氧化碳易与碱性溶液反应,所以用氢氧化钠溶液吸收即可;
(6)进行步骤⑤的操作,是为了将B中生成气体完全排出(使C、D充分吸收),防止产生误差;该操作中推注射器时缓缓的目的是防止气流过快,C、D不能充分吸收;
(7)由于浓硫酸具有吸水性,所以E装置质量增加的原因是有水,气流带出D中水蒸气造成的;无水氯化钙可做吸水剂,所以无水氯化钙质量的增加量就是生成水的质量:253.6g-250g=3.6g;
(8)aCu(OH)2?bCuCO3?cH2O=(a+b)CuO+(a+c)H2O↑+bCO2↑
根据方程式由B、C、D、E中的数据变化值,根据分解方程式算出 (a+c)/(a+b)=1、以及2b=a+c、2b=a+b 代入:2a+3b+c中,可算出a=b、a=c,即:a:b:c=1:1:1故答案为:(一)猜想与假设:
猜想一:CuSO4+Na2CO3=CuCO3↓+Na2SO4猜想二:碱性
(三)设计与实验:
(1)过滤(2)二氧化碳(CO2)
(3)Fe+H2SO4═FeSO4+H2↑ Fe+CuSO4═FeSO4+Cu
结论:猜想 二 不成立.
Ⅲ.固体成分定量测定:
问题探究:
(4)Cu(OH)2 CuO+H2O↑;CuCO3
CuO+H2O↑;CuCO3 CuO+CO2↑;
CuO+CO2↑;
aCu(OH)2?bCuCO3?cH2O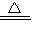 (a+b)CuO+a H2O↑+bCO2↑.B中固体没有完全变黑(或装置C、装置D的质量还在变化)
(a+b)CuO+a H2O↑+bCO2↑.B中固体没有完全变黑(或装置C、装置D的质量还在变化)
(5)氢氧化钠溶液(氢氧化钾或氢氧化钡等),吸收B中生成的二氧化碳.
(6)将B中生成气体完全排出(使C、D充分吸收);防止气流过快,C、D不能充分吸收.
数据处理:
(7)气流带出D中水蒸气;3.6 g;
(8)a:b:c=1:1:1.
点评:解答本题关键是要知道方程式的书写方法,氢氧化钠和浓硫酸的作用,了解操作中推注射器时缓缓的目的.
解答:解:(一)猜想与假设:反应物是硫酸铜和碳酸钠,生成物是碳酸铜沉淀和硫酸钠;碳酸钠虽然属于盐但是显碱性,俗称为纯碱;
(三)设计与实验:(1)不溶于液体的固体和液体分离的方法是过滤;(2)由于二氧化碳能使澄清石灰水变浑浊,所以无色气体是二氧化碳;
(3)由于加入的硫酸是过量的,所以加入铁后,铁与硫酸反应生成硫酸亚铁和氢气,氢气后面标上上升符号;由于前面加入硫酸后生成了硫酸铜,所以加入铁后,铁与硫酸铜反应生成铜和硫酸亚铁;因为加入硫酸后产生气体,说明其中需要含有碳酸根离子,而猜想二中没有碳酸根,所以不成立;
(4)根据Cu(OH)2、CuCO3受热易分解,各生成对应的两种氧化物,所以氢氧化铜分解的生成物是氧化铜和水,反应条件是加热;碳酸铜分解后生成氧化铜和二氧化碳,二氧化碳后面标上上升符号,反应条件是加热;根据氢氧化铜和碳酸铜受热分解的生成物,可知aCu(OH)2?bCuCO3?cH2O分解的生成物是氧化铜、水、二氧化碳;用观察法配平,二氧化碳后面标上上升符号;
(5)因为D中的药品主要是用来吸收二氧化碳的,由于二氧化碳易与碱性溶液反应,所以用氢氧化钠溶液吸收即可;
(6)进行步骤⑤的操作,是为了将B中生成气体完全排出(使C、D充分吸收),防止产生误差;该操作中推注射器时缓缓的目的是防止气流过快,C、D不能充分吸收;
(7)由于浓硫酸具有吸水性,所以E装置质量增加的原因是有水,气流带出D中水蒸气造成的;无水氯化钙可做吸水剂,所以无水氯化钙质量的增加量就是生成水的质量:253.6g-250g=3.6g;
(8)aCu(OH)2?bCuCO3?cH2O=(a+b)CuO+(a+c)H2O↑+bCO2↑
根据方程式由B、C、D、E中的数据变化值,根据分解方程式算出 (a+c)/(a+b)=1、以及2b=a+c、2b=a+b 代入:2a+3b+c中,可算出a=b、a=c,即:a:b:c=1:1:1故答案为:(一)猜想与假设:
猜想一:CuSO4+Na2CO3=CuCO3↓+Na2SO4猜想二:碱性
(三)设计与实验:
(1)过滤(2)二氧化碳(CO2)
(3)Fe+H2SO4═FeSO4+H2↑ Fe+CuSO4═FeSO4+Cu
结论:猜想 二 不成立.
Ⅲ.固体成分定量测定:
问题探究:
(4)Cu(OH)2
 CuO+H2O↑;CuCO3
CuO+H2O↑;CuCO3 CuO+CO2↑;
CuO+CO2↑;aCu(OH)2?bCuCO3?cH2O
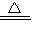 (a+b)CuO+a H2O↑+bCO2↑.B中固体没有完全变黑(或装置C、装置D的质量还在变化)
(a+b)CuO+a H2O↑+bCO2↑.B中固体没有完全变黑(或装置C、装置D的质量还在变化)(5)氢氧化钠溶液(氢氧化钾或氢氧化钡等),吸收B中生成的二氧化碳.
(6)将B中生成气体完全排出(使C、D充分吸收);防止气流过快,C、D不能充分吸收.
数据处理:
(7)气流带出D中水蒸气;3.6 g;
(8)a:b:c=1:1:1.
点评:解答本题关键是要知道方程式的书写方法,氢氧化钠和浓硫酸的作用,了解操作中推注射器时缓缓的目的.

练习册系列答案
相关题目