题目内容
【题目】某化学兴趣小组在老师指导下进行课外实验,利用下列装置来探究磷单质在空气中燃烧后氧气浓度的变化情况。
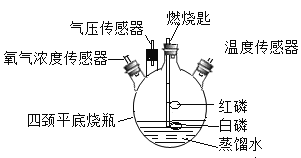
(提出问题)足量红磷在密闭的四颈平底烧瓶内燃烧熄灭后,容器中是否有氧气剩余?
(猜想假设)猜想①:有氧气剩余;
猜想②:无氧气剩余。
(实验验证)该小组同学按图组装好实验装置,利用高能激光笔照射燃烧匙上的红磷,红磷燃烧直至熄灭;待装置完全冷却后,将装有白磷的燃烧匙提出水面,再次用高能激光笔照射,白磷居然也被点燃。
(1)激光笔的作用是__________
(2)红磷燃烧产物与瓶底热水反应生成磷酸(H3PO4)的化学方程式为__________
(3)实验过程中,燃烧匙内的白磷先未燃着的原因是__________
(实验结论)根据上述实验现象,得出结论如下:
(4)结论1:猜想__________正确。
结论2:课本上用“燃烧红磷测定空气中氧气含量”的方法是__________(填“严谨”或“不严谨”)的,其理由是__________
(若回答下列小题,奖励4分,但化学总分不超过60分)
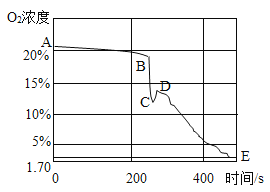
(拓展延伸)如图是该小组同学从开始实验到最后装置冷却后的整个实验过程中,用氧气传感器测量容器内氧气浓度变化的曲线图。
(5)在图中__________(填“A、B、C、D、E”)点时红磷燃烧熄灭;请你解释曲线AB段、DE段氧气浓度变化的主要原因:①__________②__________
小组同学通过查阅资料可知,验证空气中氧气体积分数较好的药品是铁丝绒,利用铁与氧气、水等的缓慢氧化,可以将空气中氧气浓度消耗至0.2%。将足量细铁丝绒置于试管底部,并倒扣在装有水的烧杯中(如图),一段时间后你将看到的现象是__________

【答案】使温度达到红磷、白磷的着火点 ![]() 没有与氧气接触 ① 不严谨 足量红磷不能把装置中的氧气耗尽 C 红磷没有燃烧,氧气浓度没有明显变化 白磷燃烧消耗氧气,导致氧气浓度减小 细铁丝绒生锈,试管中的液面约上升至试管中空气总体积的五分之一处
没有与氧气接触 ① 不严谨 足量红磷不能把装置中的氧气耗尽 C 红磷没有燃烧,氧气浓度没有明显变化 白磷燃烧消耗氧气,导致氧气浓度减小 细铁丝绒生锈,试管中的液面约上升至试管中空气总体积的五分之一处
【解析】
根据可燃物燃烧的条件:温度达到可燃物着火点,与氧气接触进行分析;根据反应物和生成物及反应条件书写化学方程式;根据铁和水、氧气同时接触时容易生锈进行分析解答。
(1)激光笔的作用是使温度达到红磷、白磷的着火点。
故填:使温度达到红磷、白磷的着火点。
(2)红磷燃烧产物是五氧化二磷,与瓶底热水反应生成磷酸(H3PO4),反应的化学方程式为:![]() 。
。
故填![]() 。
。
(3)实验过程中,燃烧匙内的白磷先未燃着的原因是没有与氧气接触。
故填:没有与氧气接触。
(4)白磷能够燃烧,说明装置中含有氧气,即红磷没有把装置中的氧气耗尽,因此猜想①正确;课本上用“燃烧红磷测定空气中氧气含量”的方法是不严谨的,其理由是足量红磷不能把装置中的氧气耗尽。
故填:①;不严谨;足量红磷不能把装置中的氧气耗尽。
(5)在图中C点时红磷燃烧熄灭;AB段:红磷没有燃烧,氧气浓度没有明显变化;DE段:白磷燃烧消耗氧气,导致氧气浓度减小;一段时间后将看到的现象是细铁丝绒生锈,试管中的液面约上升至试管中空气总体积的五分之一处。
故填:C;AB段:红磷没有燃烧,氧气浓度没有明显变化;DE段:白磷燃烧消耗氧气,导致氧气浓度减小;细铁丝绒生锈,试管中的液面约上升至试管中空气总体积的五分之一处。

【题目】通过对已学知识的对比和归纳,可以得出一些十分有趣的规律.这些规律可以帮助我们掌握学习化学的方法.请你仔细阅读表中的内容,并回答相应的问题.
常见的几种离子 | H+ Na+ Mg2+ OH- Cl- SO42 | ||
对应元素及原子团在化合物中的化合价 |
| ||
所能形成化合物的化学式 | 含有氢离子的化合物举例 | 含有氢氧根离子的化合物举例 | 其他化合物举例 |
HCl、H2SO4 | NaOH、Mg(OH)2 | MgCl2、Na2SO4 | |
(1)由前两行内容对照可得出的规律是:元素或原子团的化合价数值往往与相应离子所带的_____数相等:
(2)由后两行内容对照可得出的规律是:通过元素或原子团的_____可以确定相应化合物的化学式.
(3)利用表格中所给内容,请你再写出一种全都由非金属元素组成且含有原子团的化合物的化学式_____.
(4)请你写出由H+、Na+、SO42-三种离子组成的物质的化学式_____.
【题目】下列实验所对应的四个图象中,不正确的是( )
|
|
|
|
A向 NaOH 溶液滴加足量的水 | B将一定质量硝酸钾和饱和溶液升高 温度 | C加热 KClO3,MnO2混合物 | D完全相同的过氧化氢溶液制取 氧气 |
A.AB.BC.CD.D
【题目】实验室现有氯化镁和硫酸钠的固体混合物样品,小明同学想测定样品中氯化镁的质量分数。先称取该混合物样品20g,完全溶于水中。然后取用了一定溶质质量分数的氢氧化钠溶液100g平均分四次加入其中,充分振荡,实验所得数据见下表,请你分析并进行有关计算:
| 1 | 2 | 3 | 4 |
加入氢氧化钠溶液的质量/g | 25 | 25 | 25 | 25 |
生成沉淀的质量/g | 2.9 | x | 8.7 | 8.7 |
(1)上表中x的数值为____________;
(2)计算原固体混合物样品中氯化镁的质量分数是多少_______?
【题目】请完成下列实验,回答问题。
某同学将氢气与空气混合,在安全保障下在老师指导下点燃,实验如下
V(H2)/V(空气) | 1:99 | 3:97 | 4:96 | 50:50 | 70:30 | 75:25 |
点火 | 不炸 | 不炸 | 炸 | 炸 | 炸 | 不炸 |
(1)该实验说明氢气的爆炸极限范围可能为_____~_____之间(用百分数表示)
(2)鉴于该实验爆炸的危险性,说明点燃氢气前必须验纯,验纯的操作为_____。
(3)该实验证明水是由_____组成的。