题目内容
【题目】化学家侯德榜先生发明了“侯氏制碱法”,其原理中重要的一步是向饱和食盐水中先后通入足量NH3和CO2制备NaHCO3,化学方程式:NaCl+NH3+CO2+H2O═NaHCO3↓+NH4Cl。某兴趣小组在实验室模拟该过程,请结合具体的步骤回答下列问题:
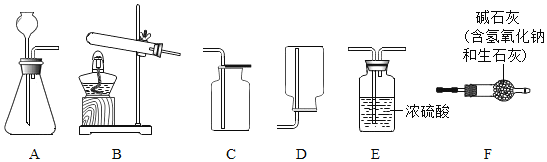
I.气体制备
(1)二氧化碳气体制备实验室常采用石灰石与稀盐酸反应制备CO2,其化学方程式为____________________________.应选择的气体收集装置为____________________________(选填装置对应的字母).实验室不用稀硫酸与石灰石制取二氧化碳的原因是__________________________________________。
(2)氨气制备
实验室常用氢氧化钙固体与氯化铵固体加热制备NH3反应方程式:______________________________________________;现要制备并收集干燥的NH3,所选装置的正确连接顺序为 B→______________________ →_______________________ (选择装置对应的字母).实验室制备O2也可用上述制备NH3的发生装置,写出用该发生装置制备O2的化学方程式_____________________________________________________.
II.NaHCO3制备
物质 | NaHCO3 | NH4Cl |
溶解度/g(20℃) | 9.6 | 37.2 |
(3)根据表格中的溶解度数据,解释20℃产物中NaHCO3能够先从溶液中结晶析出的原因 ______________________________.
(4)该过程中另一产物NH4Cl在农业生产中常被用作_______________.
【答案】CaCO3+2HCl═CaCl2+H2O+CO2↑ C 硫酸和碳酸钙反应生成的硫酸钙微溶,附着在碳酸钙的表面,从而阻止了进一步反应 Ca(OH)2+2NH4Cl![]() 2NH3↑+CaCl2+2H2O F D 2KClO3
2NH3↑+CaCl2+2H2O F D 2KClO3![]() 2KCl+3O2↑ 20℃时碳酸氢钠的溶解度小于氯化铵的溶解度 氮肥
2KCl+3O2↑ 20℃时碳酸氢钠的溶解度小于氯化铵的溶解度 氮肥
【解析】
(1)二氧化碳气体制备实验室常采用石灰石与稀盐酸反应制备CO2,是碳酸钙和盐酸反应生成氯化钙和水以及二氧化碳,对应的化学方程式为 CaCO3+2HCl═CaCl2+H2O+CO2↑.由于二氧化碳密度大于空气且能溶于水,所以只能用向上排空气法收集,所以应选择的气体收集装置为 C.实验室不用稀硫酸与石灰石制取二氧化碳的原因是 硫酸和碳酸钙反应生成的硫酸钙微溶,附着在碳酸钙的表面,从而阻止了进一步反应。
(2)实验室常用氢氧化钙固体与氯化铵固体加热制备NH3,是氢氧化钙和氯化铵在加热的条件下生成氨气和氯化钙以及水,对应的反应方程式:Ca(OH)2+2NH4Cl![]() 2NH3↑+CaCl2+2H2O.现要制备并收集干燥的NH3,干燥只能用碱石灰干燥,且收集用向下排空气法收集,所以所选装置的正确连接顺序为 BFD.实验室制备O2也可用上述制备NH3的发生装置,即加热固体制取氧气且试管口没有棉花团,所以是氯酸钾和二氧化锰的混合物在加热的条件生成氯化钾和氧气,对应的化学方程式 2KClO3
2NH3↑+CaCl2+2H2O.现要制备并收集干燥的NH3,干燥只能用碱石灰干燥,且收集用向下排空气法收集,所以所选装置的正确连接顺序为 BFD.实验室制备O2也可用上述制备NH3的发生装置,即加热固体制取氧气且试管口没有棉花团,所以是氯酸钾和二氧化锰的混合物在加热的条件生成氯化钾和氧气,对应的化学方程式 2KClO3![]() 2KCl+3O2↑。
2KCl+3O2↑。
(3)根据表格中的溶解度数据,解释20℃产物中NaHCO3能够先从溶液中结晶析出的原因 20℃时碳酸氢钠的溶解度小于氯化铵的溶解度。
(4)该过程中另一产物NH4Cl在农业生产中常被用作 氮肥。

 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案【题目】同学们从山上采集到一种石灰石,他们取80 g该样品进行煅烧实验(所含杂质在煅烧过程中不发生变化),测得反应后固体的质量(m)与反应时间(t)的关系如表:
反应时间t∕s | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
反应后固体的质量m∕g | 80 | 75 | 70 | 66 | 62 | 58 | 58 |
请回答下列问题:
(1)当石灰石完全反应后,生成CO2的质量.
(2)求该石灰石中CaCO3的质量分数,写出计算过程.
(3)请在如图所示的坐标图中,画出煅烧时生成气体的质量(m)随时间(t)变化的曲线.