题目内容
一次趣味化学活动中,王老师向同学们展示了一瓶标签受损的无色溶液,如图所示。要求同学们进行探究:确认这瓶溶液究竟是什么溶液?
【提出猜想】王老师提示:这瓶无色溶液只能是下列四种溶液中的一种:①硫酸镁溶液;②硫酸钠溶液;③硫酸溶液;④硫酸铵溶液
【查阅资料】
①常温下,相关物质的溶解度如下:
| 物质 | MgSO4 | Na2SO4 | (NH4)2SO4 | H2SO4 |
| 溶解度 | 35.1g | 19.5g | 75.4g | 与水任意比互溶 |
②(NH4)2SO4的水溶液显酸性
(1)【实.验探究】小明对王老师的提示进行了评价不可能是Na2SO4,原因是 。
(2)为确定其它几种猜想是否正确,小明同学继续进行探究:
| 实验操作 | 实验现象 | 实验结论 |
| ①取该溶液少许于试管中,向其中滴加几滴 溶液 | 溶液中有白色沉淀生成 | 猜想①成立 |
| ②用玻璃棒蘸取少许原溶液滴在pH试纸上,并跟标准比色卡对照 | 溶液pH小于7 | 猜想③成立 |
小雅对小明实验操作②的结论评价是 ,理由是 _;
(3)请你设计实验方案,确认该溶液是硫酸铵溶液并完成实验报告:
| 实验操作 | 实验现象 | 实验结论 |
| 取该溶液少许于试管中, ① ②将湿润的红色石蕊试纸放在试管口 | ①产生有刺激性气味的气体 ② | 猜想④成立,该反应的化学方程式为 |
(1)常温下Na2SO4溶液的溶质质量分数不可能达到20%。
(2)① NaOH (或氢氧化钠)(答案合理即可) 结论不正确(或结论错误) (NH4)2SO4溶液也呈酸性
(3)实验操作 实验现象 实验结论 向试管中加入少量NaOH溶液并加热,将湿润的红色石蕊试纸放在试管口 有刺激性气味的气体产生,
红色石蕊试纸变蓝(NH4)2SO4+2NaOH  Na2SO4+2NH3↑+2H2O
Na2SO4+2NH3↑+2H2O
解析试题分析:从资料信息可以看出,硫酸钠的溶液解度是19.5g,在硫酸钠形成饱和溶液时,所得到的溶质质量分数最大只能是: ×100%=16.3%,而达不到20%,所以小明认为药品不可能是硫酸钠溶液;能与硫酸镁反应产生白色沉淀的物质是氢氧化钠溶液,所以要证明该药品是硫酸镁,并产生白色沉淀现象,所加药品应该是氢氧化钠溶液;因为硫酸溶液、硫酸铵溶液都显酸性,其pH都小于7,所以小雅认为小明的实验操作②的结论是错误的;硫酸铵是铵态氮肥,它能与碱性物质反应并施放出氨气,氨气的水溶液就是氨水,显碱性,能使红色石蕊试纸变蓝色。
×100%=16.3%,而达不到20%,所以小明认为药品不可能是硫酸钠溶液;能与硫酸镁反应产生白色沉淀的物质是氢氧化钠溶液,所以要证明该药品是硫酸镁,并产生白色沉淀现象,所加药品应该是氢氧化钠溶液;因为硫酸溶液、硫酸铵溶液都显酸性,其pH都小于7,所以小雅认为小明的实验操作②的结论是错误的;硫酸铵是铵态氮肥,它能与碱性物质反应并施放出氨气,氨气的水溶液就是氨水,显碱性,能使红色石蕊试纸变蓝色。
考点:饱和溶液、盐的化学性质。

(10分)钛(Ti)是一种重要的航天金属材料.某学习小组对三种金属Ti、Al、Cu的金属活动性顺序进行探究.过程如下:
提出假设:a.Ti金属活动性比Al强 b.Al金属活动性比Cu强
查阅资料:钛能与盐酸反应.
实验设计:同温下,取大小相同的这三种金属薄片,分别投入等体积等浓度的足量的稀盐酸中反应,观察现象.
操作分析:三种金属加入盐酸前都先用砂布将表面擦光亮,其目的是
A.除去氧化膜,利于直接反应
B.使表面光亮,易观察现象
C.使反应金属温度相同,易反应
| 金属 | Ti | Al | Cu |
| 与盐酸反应现象 | 反应缓慢 | 反应剧烈 | 无明显现象 |
实验现象,实验结论:
(1)原假设中 不正确(填“a”、“b”或“a、b”).
(2)三种金属的金属活动性由强至弱的顺序为 。
结论应用:能否用铝制容器来盛装波尔多液(含硫酸铜), (填“能”或“否”),理由是 。
不少同学都被蚊虫叮咬过,感觉又痛又痒.同学们从化学课上知道:蚊虫叮咬时能在人的皮肤内分泌出蚁酸刺激皮肤.课外兴趣小组同学决定对蚁酸进行探究。
【提出问题】蚁酸的成分是什么?它有什么性质?
【查阅资料】蚁酸是一种有机酸,化学名称叫做甲酸,化学式为HCOOH;蚁酸在一定条件下会分解生成两种氧化物。
【实验探究一】探究蚁酸的酸性。
(1)向盛有蚁酸溶液的试管中滴加紫色石蕊试液,观察到溶液颜色变成 色,说明蚁酸溶液显酸性;
(2)将锌粒放入盛有蚁酸溶液的试管中,有气泡产生,该气体是 。
【实验探究二】探究蚁酸分解的两种产物。
(1)小芳同学根据蚁酸中含有 元素,推测出生成物中含有水;
(2)另一种生成物是气体,小敏提出两种猜想:
猜想①:该气体是CO2 猜想②:该气体是 他们将蚁酸分解产生的气体通过如下装置(铁架台已略去),观察现象。
Ⅰ.实验时装置A中无明显变化,则猜想① (填“成立”或“不成立”);
Ⅱ.装置B中的现象是 ,装置C中发生反应的化学方程式为 。
【讨论交流】从环保角度看,该装置的缺陷是 ,处理的方法是 。
【拓展延伸】
(1)当你被蚊虫叮咬后,在叮咬处涂抹一些物质可减轻痛痒.下列物质中,你不会选择的物质是 。
| A.氨水 | B.食醋 | C.肥皂水 | D.苏打水 |
在学习盐的性质时,某组同学将碳酸钠溶液和一瓶标签破损的溶液M(如图)进行反应,有白色沉淀产生,过滤后得到澄清滤液.同学们对该实验进行了一系列的研究.
探究一 M溶液中的溶质是什么?
(1)【提出猜想】该组同学认为M溶液的溶质有两种可能:①是 ,②是CaCl2.
【收集资料】CaCl2水溶液呈中性.
(2)【设计实验】同学们设计了如下方案并进行实验:
| 实验操作 | 实验现象 | 实验结论 |
| 取少量M溶液于试管中,向其中滴加 | | 猜想①正确,碳酸钠与其反应的化学方程式为 |
探究二 过滤后澄清滤液中会有哪些溶质?
【提出猜想】猜想一:NaOH和Na2CO3;猜想二:_____;猜想三:NaOH
(3)【实验验证】同学们针对“猜想一”进行了如下实验:
| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中,滴入几滴稀盐酸 | 没有气体产生 | “猜想一”不成立 |
他们的实验结论是否正确? ,理由是 .
(4)【继续探究】设计实验方案确定滤液中溶质的组成.
| 实验操作 | 实验现象 | 实验结论 |
| 分别取少量滤液于A、B两支试管中,A中加入CaCI2溶液,B中加入 溶液 | 若A中产生白色沉淀,B中没有沉淀 | “猜想一”成立 |
| | “猜想二”成立 | |
| | “猜想三”成立 |

某化学兴趣小组的同学往氢氧化钠溶液中滴加稀盐酸时,没有看到明显现象.
【提出问题】氢氧化钠与盐酸是否发生了化学反应?
【查阅资料】酸与碱发生中和反应会放出热量.
【实验设计】甲、乙、丙三位同学分别设计了如下实验方案,请你帮他们完成实验报告.
| 同学 | 实验操作 | 现象 | 结论 |
| 甲 |  | 溶液由红色变成 | 氢氧化钠与盐酸发生了化学反应,反应的化学方程式为 |
| 乙 | 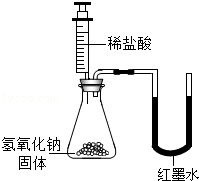 | U型玻璃管中 边的红墨水液面下降(所加稀盐酸的体积忽略不计) | 氢氧化钠与盐酸发生了化学反应 |
| 丙 | 用 测定氢氧化钠溶液的pH,向其中滴加足量稀盐酸,再测定溶液的pH | 最后溶液的pH (填“≥7”、“≤7”、“不变” | 氢氧化钠与盐酸发生了化学反应 |
【评价反思】你认为实验设计方案不合理的同学是 ,理由是 .
【拓展延伸】另有一位同学向自己配制的氢氧化钠溶液中滴加酚酞试液时,溶液变红色,可是红色即可消失了,出现此意外情况的原因是 (填以下序号).
A.所用的酚酞试液是变质的
B.所用的氢氧化钠溶液浓度太小
C.氢氧化钠溶液吸收了空气中二氧化碳



