题目内容
在学习过程中,可以判断反应发生的方法有多种。
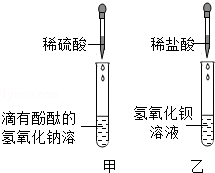
(1)向盛有10mL稀盐酸的烧杯中加入氢氧化钠溶液,用pH计(测pH的仪器)测定溶液的pH,所得数据如下:
| 加入NaOH溶液的体积/mL | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 |
| 烧杯中溶液的pH | 1.1 | 1.2 | 1.4 | 1.6 | 2.0 | 7.0 | 11.0 | 12.2 |
当加入氢氧化钠溶液的体积为 mL时,稀盐酸和氢氧化钠溶液恰好完全反应。
(2)在图的实验中,当观察到的现象是 就可证明NaOH与HCl发生了反应。
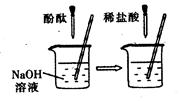
(3)不使用指示剂或pH试纸等方法,也可证明反应发生。向稀盐酸和氢氧化钠混合后的溶液中加入一种物质,若没有明显现象出现,说明溶液失去了酸性,从而证明稀盐酸和氢氧化钠已经发生了反应,则该合理的物质是 。
(1) 10 (2)溶液由红色变成无色 (3)CaCO3 (或Na2CO3等)
解析试题分析:(1)由表格中的数据可知,当加入氢氧化钠溶液的体积为10mL时,稀盐酸和氢氧化钠溶液恰好完全反应,(2)在右图的实验中,NaOH溶液中加入酚酞溶液时,溶液变红色,而在中性或酸性溶液中酚酞都不变色,故当观察到的现象是溶液由红色变成无色, 就可证明NaOH与HCl发生了反应。(3)只要加入的物质能与稀盐酸反应,不能与氢氧化钠反应,且有明显现象都可,
考点:酸碱中和反应。

 名校课堂系列答案
名校课堂系列答案某校研究性学习小组在学习了双氧水分解制氧气的实验后,知道催化剂(Mn02,)能改变化学反应速率。到底Mn02是不是该反应的催化剂以及还有哪些因素与化学反应速率有关呢?
【小组讨论】:小明同学观点:化学反应速率与反应物的质量分数有关;
小红同学观点:化学反应速率与反应温度有关;
小峰同学观点:化学反应速率与 有关。
【设计实验】:为了验证他们的观点,设计并进行了以下实验: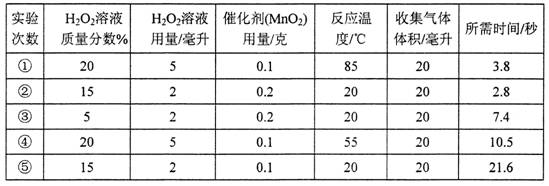
(1)请你写出实验中所发生的化学反应方程式 ;
(2)____实验证明小明的观点是正确的,_______实验证明小红的观点是正确的。
| A.①和② | B.②和③ | C.③和④ | D.①和④E.②和⑤ |
(4)加入Mn02后,H202分解的速率大大提高,为了证明Mn02是该反应的催化剂,必须检验其质量没有改变,可通过 (填操作名称)将其分离出来称量,同时还应检验其 没有改变。
实验是学习化学的重要手段,请阅读下列实验装置图,回答有关问题。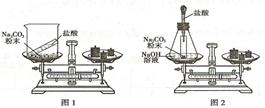
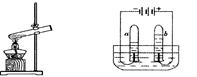
图3水蒸发实验 图4电解水实验
(1)同学们先按图1的方式实验,该实验中,大家进行了两次称量,有四个小组得到下列数据,其中有问题的两组数据是 (填序号)。
| | A | B | C | D |
| 盐酸加入Na2 CO3粉末前称量/g | 85.3 | 82.8 | 84.8 | 86.5 |
| 盐酸加入Na2 CO3粉末后称量/g | 85.3 | 80.6 | 83.2 | 87.8 |
(2)同学们又按照图2的方式实验,当天平平衡后,挤压胶头滴管逐滴滴人盐酸,最终天平的状态是 (填序号)。A.左盘高 B.右盘高 C.保持平衡
(3)比较图3和图4两个实验中水的变化,用分子原子的观点分析其不同点: ;图4中b得到的气体为
为了解环境因素对维生素C含量的影响,从而更好地保存有关食物,某兴趣小组同学根据维生素C可使高锰酸钾(KMn04;)溶液褪色的原理,进行了如下表所示的实验。
| 编号 | 维生素C溶液的处理方法 | 使40毫升KMn04溶液褪色的平均滴数 |
| 1 | 放置于室内暗处0.5小时 | 15 |
| 2 | 强烈阳光直射5小时后,放置于室内暗处0.5小时 | 22 |
| 3 | 煮沸l0分钟后,放置于室内暗处0.5小时 | 21 |
(1)他们探究了_______ ____对维生素C含量的影响;
(2)他们的探究对我们启示是:在贮存富含维生素C的食物时,应________________,以防止其中的维生素C过量流失,降低食物的营养价值;
(3)为了解维生素C的化学性质,他们用pH试纸测得该维生素C溶液的pH在1至2之间,说明维生素C具有________性。
在化学实验室里,酒精是最常用到的一种燃料,其化学式是C2H6O。小明为了证明酒精中含有碳、氢元素,设计并完成如下实验方案。请你帮他完成下面的实验报告。
【实验目的】:证明酒精中含有碳、氢元素。
【实验用品】:酒精灯、火柴、洁净干燥的小烧杯、澄清石灰水
【实验过程及结论】
| 实验步骤 | 实验现象 | 实验结论 |
| 步骤一:点燃酒精灯,将洁净干燥的小烧杯罩在火焰上方 | 烧杯内壁 有 生成; | 证明酒精中含有 元素 |
| 步骤二:迅速取下烧杯,并加入少量 ,振荡; | | 证明酒精中含有碳元素 |
甲同学对寒痛乐熨剂(简称“寒痛乐”)的发热原理产生了浓厚兴趣,于是带了几包寒痛乐,来到实验室对其进行研究。

【查阅资料】
[ 用法用量 ] 外用,一日1次。将外袋剪开,取出药袋,晃动数次,使药物充分松散,接触空气,手摸有热感时,置于固定袋内,覆盖于痛患处,每袋可发热不少于15小时。
[ 原料层 ] 铁、蛭石、活性炭、水等。
[ 作用原理 ] 铁跟氧气和水反应生成氢氧化铁(固体),并放热。
【实验一】验证寒痛乐成分中所含铁的化学性质。
| 步骤 | 实验操作 | 实验现象 |
| | 将寒痛乐打开,将药物倒入一烧杯中,观察 | 药物为黑色固体粉末 |
| | 用一条形磁铁与烧杯中的黑色粉末充分接触,取适量吸附在磁铁上的黑色粉末放于燃烧匙中,在酒精灯上点燃后伸入盛有氧气的集气瓶中,观察 | 剧烈燃烧, |
实验结论:写出此反应的文字表达式 。
集气瓶中加水的作用是 。
【实验二】用寒痛乐熨剂药粉测定空气中氧气的含量。
甲同学设计了如下图所示装置,进行实验。
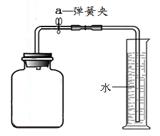
【实验记录
| 步骤 | 实验操作 | 主要实验现象 | 实验结论及解释 |
| | 连接好装置如上图所示,然后 | | 装置的气密性良好 |
| | 加入足量药品,迅速将胶塞盖严,并充分振荡 | | 进入集气瓶内水的体积即为空气中氧气的含量。 |
【实验反思】乙同学认为甲同学所做“寒痛乐药粉测定空气中氧气的含量”的实验不能证明上述结论,他将操作改进后再进行测量,得到了较为准确的结果。他改进后的操作为
。