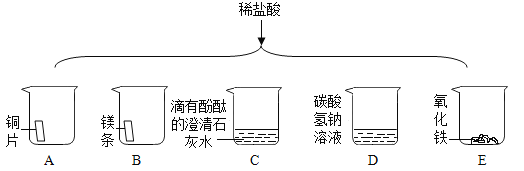
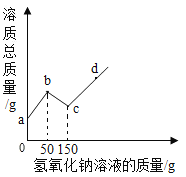
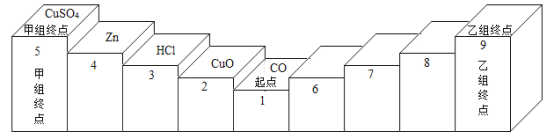
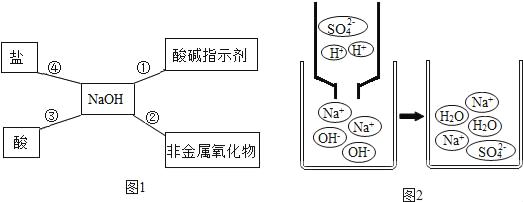
��Ŀ����
����Ŀ�����е�H+û�б�����ȫ�к�ʱ���ɵIJ���Ϊ��ʽ�Σ����Լ����ͼ����Ӧ��ͬѧ�Ƿ��ֽ�һ������NaOH��Һ���뵽NaHCO3��Һ�У���Ϻ��������������֤���������ʷ����˻�ѧ��Ӧ����Ӧ����������Щ����ѧʵ�����ͬѧ����������̽����
���������ϣ�![]()
��ʵ��̽��1����һ���������������ģ�NaHCO3��Na2CO3����Һ��������ʵ��
|
| |
��ϡ���� | A | �������� |
����ɫ��̪��Һ | ��Һ���ɫ | ��Һ���ɫ |
��CaCl2��Һ | ���������� | B |
�ϻ�������A����ʵ������Ϊ_____���B��ʵ�������ԭ����_____���û�ѧ����ʽ��ʾ����
����������裩ͬѧ�ǶԷ�Ӧ����Һ�����ʵijɷֽ����˲���
����1��![]()
����2��![]() ��
��![]()
����3��N![]() ��
��![]()
��ʵ��̽��2��
ʵ�鲽�� | ʵ������ | ʵ����� |
��ȡ��Ӧ����Һ�������Թ��У���ӹ����� | _____ | ������2��ȷ �� |
�����˺�����Һ�м�2��3����ɫ��̪��Һ | _____ | |
���ٵμ�������_____ | _____ |
�������뽻��������û����������Ļ�ѧ��Ӧ������ͨ�����������������ɻ����_____�ķ�����֤����Ӧ�����ˡ�
���𰸡��������� ![]() ������ɫ���� Һ��Һ���ɫ ���� ��Һ�����ɫ ���鷴Ӧ��
������ɫ���� Һ��Һ���ɫ ���� ��Һ�����ɫ ���鷴Ӧ��
��������
[ʵ��̽��1]�����̼�����Ʒ�Ӧ�����Ȼ��ơ�ˮ�Ͷ�����̼��������A����ʵ������Ϊ���������ݣ��Ȼ��ƺ�̼���Ʒ�Ӧ���ɲ�����ˮ������ƺ��Ȼ��ƣ���ѧ����ʽΪ��![]() ��
��
[ʵ��̽��2]����Ϊ����2��ȷ����Һ�к���![]() ��
��![]() ���Ȼ��ƺ�̼���Ʒ�Ӧ���ɲ�����ˮ������Ƴ�������������ɫ������
���Ȼ��ƺ�̼���Ʒ�Ӧ���ɲ�����ˮ������Ƴ�������������ɫ������
����Ϊ�����������ƣ���Һ�ʼ��ԣ��μ���ɫ��̪��Һ��Һ���ɫ��
���ٵμ����������ᣬ��Һ�����ɫ��
[�����뽻��]ͨ��[ʵ��̽��1]��[ʵ��̽��2]˵��������û����������Ļ�ѧ��Ӧ�����Դ�������ͬ�ĽǶ�֤����Ӧ�ķ������������Ƕ��ǣ�һ�ǿ���ͨ�����鷴Ӧ��֤����Ӧ���������ǿ���ͨ���������֤����Ӧ������
�ʴ�Ϊ��
[ʵ��̽��1]�������� ![]() ��
��
[ʵ��̽��2]�ٲ�����ɫ������
��Һ��Һ���ɫ��
������ ��Һ�����ɫ��
[�����뽻��]���鷴Ӧ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�