题目内容
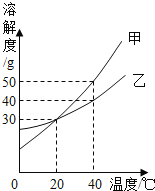
【题目】向一定量的硝酸银、硝酸铝和硝酸铜的混合溶液中加入一定量的锌,溶液质量与加入锌的质量关系如图。请回答:
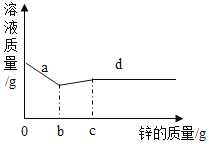
(1)写出a点所发生反应的化学方程式:_____;
(2)d点对应的溶液中溶质有哪些?_____
(3)当加入锌的质量在bg~cg时,溶液的质量为什么会增加?_____
【答案】Zn+2AgNO3=Zn(NO3)2+2Ag 硝酸锌、硝酸铝 当加入锌的质量在bg~cg时,参加反应的溶质硝酸铜的质量小于生成物硝酸锌的质量,所以溶液的质量增加
【解析】
四种金属的活动性顺序是:铝、锌、铜、银,所以向一定量的硝酸银、硝酸铜和硝酸铝的混合溶液中加入Zn,锌会先与硝酸银反应,然后再与硝酸铜反应,a→b溶液质量减小,发生的反应是锌和硝酸银反应生成硝酸锌和银,溶液质量逐渐减小,b→c段发生的反应是锌和硝酸铜反应生成硝酸锌和铜。
(1)由分析可知,当加入锌的质量为ag时,溶液质量没有减小到最小,说明硝酸银没有完全反应,锌和硝酸银反应生成硝酸锌和银,化学方程式为:Zn+2AgNO3=Zn(NO3)2+2Ag;
(2)当加入锌的质量为d g时,加入的锌是过量的,硝酸银、硝酸铜完全反应生成硝酸锌,硝酸铝没有反应,所以溶液中的溶质有硝酸锌、硝酸铝;
(3)当加入锌的质量在b-cg时,每65份质量的锌和硫酸铜反应生成硫酸锌和64份质量的铜,固体质量减少,所以反应后溶液质量增加。

练习册系列答案
相关题目
【题目】下图中,四圆甲、乙、丙、丁分别表示一种溶液,两圆的相交部分为两溶液混合后出现的主要实验现象,下表中不符合图示关系的是
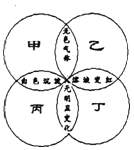
甲 | 乙 | 丙 | 丁 | |
A | Na2CO3 | H2SO4 | BaCl2 | 紫色石蕊 |
B | (NH4)2SO4 | NaOH | Ba(NO3)2 | 无色酚酞 |
C | K2CO3 | HCl | Ba(OH)2 | 紫色石蕊 |
D | HCl | Na2CO3 | AgNO3 | 无色酚酞 |