题目内容
【题目】(4分)根据图中a、b、c三种物质的溶解度曲线,回答下列问题:
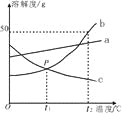
(1)P点表示在t1℃两物质的溶解度关系为b c(填“>”、“<”或“=”)。
(2)t2℃,a、b、c三种物质的饱和溶液溶质质量分数的大小关系为 。
(3)t2℃时,50 g b物质加入到50 g水中充分溶解后,所得溶液的质量为 。
(4)b中含有少量的a,若要提纯b,可采用 结晶的方法。
【答案】(1)= (2)b>a>c (3)75g(4)降温(或冷却热饱和溶液)
【解析】试题分析:根据固体物质的溶解度曲线,可以查出某温度下某物质的溶解度、可以比较不同的物质在同一温度下的溶解度的大小、可以判断固体物质的溶解度受温度影响变化的趋势等。
(1)根据溶解度曲线图可知,t1℃时,b、c两物质的溶解度曲线交于一点P,故说明在t1℃时,两物质的溶解度相等,即b=c。
(2)根据溶解度曲线图可知,b的溶解度随温度的升高而增大,因此降温后b的饱和溶液中就会有溶质析出,故溶液中溶质的质量分数就会减小;而c的溶解度随温度的升高而减小,因此降温后会变成不饱和溶液,但溶液中溶质的质量分数不变,但由于t2℃时c的溶解度仍小于t1℃时b的溶解度,再根据饱和溶液的溶质质量分数=![]() ×100﹪可知,它们各自温度下的饱和溶液的溶质质量分数大小为b>c,即降温后溶液中溶质的质量分数的大小为b>c。
×100﹪可知,它们各自温度下的饱和溶液的溶质质量分数大小为b>c,即降温后溶液中溶质的质量分数的大小为b>c。
(3)根据溶解度曲线图可知,t2℃时,b 物质的溶解度为50g,故t2℃时,26gb物质加入到50 g水中充分溶解后,只能溶解25g,则所得溶液的质量为75g。
(4)由溶解度曲线可知,a、b两物质的溶解度都随温度的升高而增大,但b的溶解度变化受温度的影响较大,a的溶解度变化受温度的影响不大,故当b中含有少量的a时,若要提纯b,可采用降温结晶的方法进行分离。

【题目】下表物质中含有少量杂质,其中除杂方法正确的是( )
物质 | 杂质 | 除去杂质的方法 | |
A | CaCl2 溶液 | MgCl2 | 加入金属钙 |
B | NaNO3 溶液 | AgNO3 | 滴入氯化钾溶液 |
C | CO2 | CO | 通入氧气,点燃 |
D | KCl | MnO2 | 加入足量的水,溶解、过滤、蒸发、结晶 |
A.AB.BC.CD.D