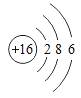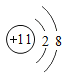题目内容
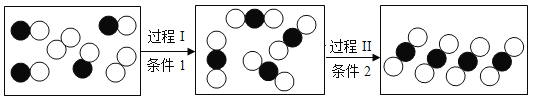
【题目】某同学设计了测定空气中氧气含量的实验,实验装置如图,实验步骤如下:
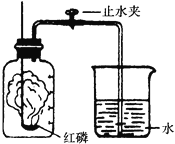
①将图中的集气瓶分为5等份,并作好标记。
②在带橡皮塞和导管的燃烧匙内装入足量的红磷,将导管上的止水夹夹紧,在酒精灯上点燃红磷,并立即伸入集气瓶内,塞紧橡皮塞。
③充分反应后,待集气瓶冷却至室温,打开止水夹。
请回答下列问题:
(1)步骤②集气瓶中的现象是_______________,其反应的文字表达式为________________。
(2)步骤③中打开止水夹后观察到的现象是_______________,由此可得出氧气约占空气总体积的__________。
(3)如果小组同学操作不当,会使测量结果产生误差,其中偏小的原因可能是__________、______________、_____________。
(4)若将红磷换成硫粉,完成上述实验,结果发现集气瓶内并未吸入水,原因是________________。
【答案】产生大量的白烟,放出热量 磷+氧气![]() 五氧化二磷 烧杯中的水会进入集气瓶中,约占集气瓶体积的1/5 氧气约占空气体积的1/5 装置漏气 红磷不足 未待冷却到室温读数 硫在空气中燃烧生成二氧化硫,瓶内的气压不降低
五氧化二磷 烧杯中的水会进入集气瓶中,约占集气瓶体积的1/5 氧气约占空气体积的1/5 装置漏气 红磷不足 未待冷却到室温读数 硫在空气中燃烧生成二氧化硫,瓶内的气压不降低
【解析】
(1)红磷燃烧产生大量的白烟,放出热量,该反应生成了五氧化二磷,反应的文字表达式为:磷+氧气![]() 五氧化二磷;
五氧化二磷;
(2)红磷燃烧燃烧消耗了氧气,集气瓶内的气压降低。步骤③中打开止水夹后观察到烧杯中的水会进入集气瓶中,约占集气瓶体积的1/5,由此得出氧气约占空气体积的1/5;
(3)如果小组同学操作不当,会使测量结果产生误差,其中偏小的原因可能是装置漏气、红磷不足、未待冷却到室温读数等;
(4)若将红磷换成硫粉,完成上述实验,结果发现集气瓶内并未吸入水,原因是硫在空气中燃烧生成二氧化硫,瓶内的气压不降低。

 巧学巧练系列答案
巧学巧练系列答案【题目】研究和控制化学反应条件有重要意义。
(1)同学们想探究双氧水的浓度对反应速率的影响。在其他条件相同的情况下进行了三次实验,记录各收集一瓶相同体积氧气所需要的时间。
实验 | 30%双氧水的质量(g) | 加入的水的体积(mL) | 二氧化锰质量(g) | 收集时间(s) |
1 | 10 | 40 | 5 | 200 |
2 | 20 | 30 | 5 | 100 |
3 | 30 | 20 | 67 |
①写出上述反应的化学符号表达式_____。
②实验3中,加入的二氧化锰质量为_____g。
③相同条件下,实验3产生氧气的速率最快,说明_____。
(2)同学通过查阅资料得知,双氧水在70℃以上会较快分解产生氧气。为了验证加热双氧水也可以产生氧气,同学们进行实验。实验中观察到试管内产生气泡,但将带火星的木条放在导管口没有复燃,可能的原因是_____。
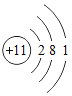
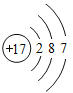
【题目】下图是常见的粒子结构示意图,请根据粒子结构示意图回答下列问题:
粒 子 结 构 示意图 |
|
|
|
|
编 号 | A | B | C | D |
(1)上述微粒示意图中表示阳离子的是_____(填编号)。
(2)由同一种元素B形成的单质是_____(填化学式)。
(3)上述微粒中属于同一种元素的是_____(填编号)。
(4)元素C在化学反应中表现出的最高化合价是_____价,C元素最高价与氧元素形成氧化物的化学式是_____。