题目内容
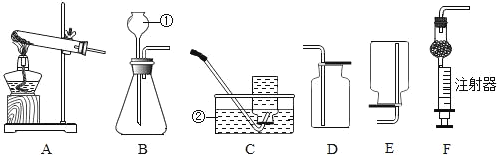
【题目】现有实验室制取气体的部分装置如图1,请结合所学知识,回答下列问题。
(1)请写出图中标有字母的仪器名称:a_____,b_____。
(2)小蕊想节省药品的同时慢慢地制取二氧化碳,她应该选择发生装置_____,并且装置还需做改动的是_____,请写出该反应的化学方程式:_____。
(3)实验室用氯酸钾制取氧气,可用的发生装置是_____,请写出反应的化学方程式:_____,
(4)实验室制取氢气的化学方程式为:_____,常用的发生和收集装置是_____,若要收集到干燥的氢气,应将发生装置与F装置的_____(填“m”或“n”)相连。
【答案】试管 酒精灯 B 用分液漏斗代替长颈漏斗 CaCO3+2HCl═CaCl2+H2O+CO2↑ A 2KClO3![]() 2KCl+3O2↑ Zn+H2SO4═ZnSO4+H2↑ BC或BE m
2KCl+3O2↑ Zn+H2SO4═ZnSO4+H2↑ BC或BE m
【解析】
(1)仪器a是试管,b是酒精灯;;
(2)实验室制取二氧化碳用大理石或石灰石与稀盐酸反应,该反应的反应物是固体和液体,不需加热,该反应属于固—液常温型,选择装置B来制取;用分液漏斗代替长颈漏斗可以控制液体滴加速率和液体的量,为节省药品的同时慢慢地制取二氧化碳,装置还需做改动的是用分液漏斗代替长颈漏斗;大理石或石灰石和主要成分是碳酸钙,碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(3)氯酸钾在二氧化锰的催化作用下加热分解为氯化钾和氧气,属于固体加热型,选择装置A来制取,反应的化学方程式为:2KClO3![]() 2KCl+3O2↑;
2KCl+3O2↑;
(4)在实验室中常用锌粒与稀硫酸反应来制取氢气,同时生成硫酸锌,反应的化学方程式为:Zn+H2SO4═ZnSO4+H2↑;该反应的反应物是固体和液体,不需加热,属于固-液常温型,氢气的密度比空气小,难溶于水,所以可用向下排空气法或排水法来收集,选择装置BC或BE来制取;用浓硫酸来干燥氢气时,为了使气体与浓硫酸私分接触,氢气应从m(短)管进入。

【题目】溶液与人们的生活息息相关。
(l)下表是三种物质在不同温度时的溶解度,根据表中信息回答问题。
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | 氯化钠 | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
硝酸钾 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 | |
氢氧化钙 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | |
①80℃的氢氧化钙饱和溶液降温至40℃,所得溶液是氢氧化钙的_____(填“饱和”或“不饱和”)溶液。
②60℃硝酸钾饱和溶液105g,若降温至20℃,析出硝酸钾晶体的质量是_____。
③20℃时,将20gNaCl加入50g水中,充分溶解,所得溶液的溶质质量分数为_____。(计算结果精确到0.1%)
④向20℃的氢氧化钙饱和溶液中加入少量生石灰,再恢复至20℃,此时溶液中钙离子数目比加入生石灰前溶液中钙离子数目_____(填“增大”“不变”或“减小”);溶液中钙离子浓度比加入生石灰前溶液中钙离子浓度_____(填“增大”“不变”或“减小”)。
⑤从硝酸钾和氯化钠(少量)的混合物中分离出硝酸钾的方法是_____(填“蒸发结晶”或“降温结晶”)。
(2)列式计算:用100g18%的氯化钠溶液配制0.9%的生理盐水,需要加水多少亳升?_____(水的密度为1.0g·mL-1)
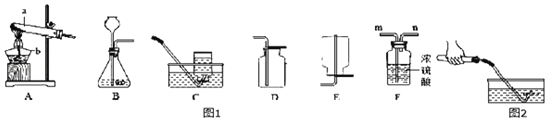
【题目】根据如图实验装置,回答问题:
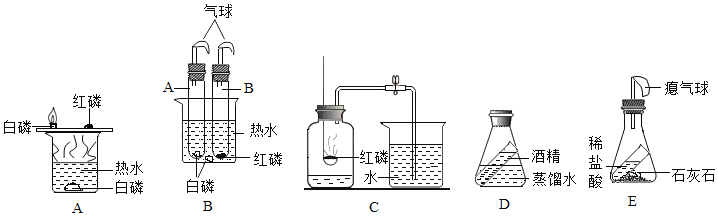
(1)A、B、C三个实验共同的反应是_____(用化学方程式表示)
(2)与A装置相比,B装置一个显著的优点是_____。
(3)C实验,若止水夹没有夹紧,会导致测得的结果_____(“偏低”或“偏高”或“无法确定”)
(4)D、E是探究质量守恒定律的实验,D实验_____(填“能”或“不能”)验证质量守恒定律,理由是_____,E实验_____(填“能”或“不能”)验证质量守恒定律,理由是_____。
(5)实验室现有三瓶无色溶液,分别是氯化钠溶液、蔗糖溶液、蒸馏水,因为标签脱落无法辨认,请你设计实验加以辨别。
实验操作 | 实验现象及结论 | |
方案一 | _____ | _____ |
方案二 | _____ | _____ |