��Ŀ����
����Ŀ��������ͼʵ��װ�ã��ش����⣺
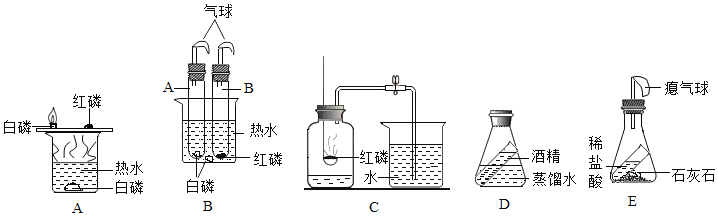
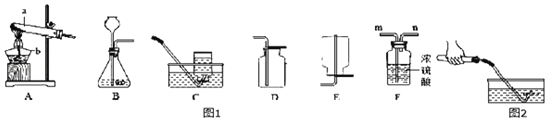
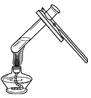
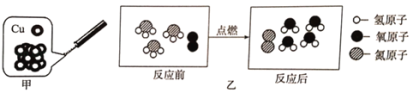
��1��A��B��C����ʵ�鹲ͬ�ķ�Ӧ��_____���û�ѧ����ʽ��ʾ��
��2����Aװ����ȣ�Bװ��һ���������ŵ���_____��
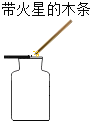
��3��Cʵ�飬��ֹˮ��û�мн����ᵼ�²�õĽ��_____����ƫ�͡���ƫ�ߡ�����ȷ������
��4��D��E��̽�������غ㶨�ɵ�ʵ�飬Dʵ��_____����ܡ����ܡ�����֤�����غ㶨�ɣ�������_____��Eʵ��_____����ܡ����ܡ�����֤�����غ㶨�ɣ�������_____��
��5��ʵ����������ƿ��ɫ��Һ���ֱ����Ȼ�����Һ��������Һ������ˮ����Ϊ��ǩ���������ϣ��������ʵ����Ա��
ʵ����� | ʵ�������� | |
����һ | _____ | _____ |
������ | _____ | _____ |
���𰸡�4P+5O2![]() 2P2O5 ���� ƫ�� ���� �ƾ���ˮ����������仯 ���� ����������ͣ�������� �ò�����պȡ������Һ���ֱ��ھƾ��ƻ����ϼ��� ���а�ɫ�������������Ȼ�����Һ�������İ�ɫ���������պ��ɺ�ɫ����������Һ��û�й���������������ˮ �Ȳⶨ��Һ�ĵ����ԣ��ٲⶨ�������������Һ���ܶ� �ܵ�������Ȼ�����Һ�����ܵ����������Һ���ܶȽ�С��������ˮ
2P2O5 ���� ƫ�� ���� �ƾ���ˮ����������仯 ���� ����������ͣ�������� �ò�����պȡ������Һ���ֱ��ھƾ��ƻ����ϼ��� ���а�ɫ�������������Ȼ�����Һ�������İ�ɫ���������պ��ɺ�ɫ����������Һ��û�й���������������ˮ �Ȳⶨ��Һ�ĵ����ԣ��ٲⶨ�������������Һ���ܶ� �ܵ�������Ȼ�����Һ�����ܵ����������Һ���ܶȽ�С��������ˮ
��������
��1��A��B��C����ʵ���о����������������ڵ�ȼ�������·�Ӧ�������������ף����4P+5O2![]() 2P2O5��
2P2O5��
��2��Bװ����һ���ܷ�װ�ã����������Ⱦ�ﲻ����ɢ�������������Ⱦ�����������
��3����ֹˮ��û�мн�������ѹǿ��������£����ܿ�������ð��������ʵ�����ݳ���һ�������壬���ս���ƿ�ڵ�ˮ���࣬�ᵼ�²ⶨ���ƫ�ߡ����ƫ�ߣ�
��4��Dװ���������仯������������֤�����غ㶨�ɣ���װ��E�����ɵĶ�����̼���������������ͣ�����������Ӱ��ʵ��IJⶨ��������ܣ��ƾ���ˮ����������仯�����ܣ�����������ͣ��������
��5������������Һ���Ȼ�����Һ���ջ���־��壬�Ҽ����������ǻ��ɺ�ɫ�����Ը���Һ��ĵ��������ܶ���������
�ʴ�
ʵ����� | ���� | |
����һ | �ò�����պȡ������Һ���ֱ��ھƾ��ƻ����ϼ��� | ���а�ɫ�������������Ȼ�����Һ �������İ�ɫ���������պ��ɺ�ɫ����������Һ ��û�й���������������ˮ |
������ | �Ȳⶨ��Һ�ĵ����ԣ��ٲⶨ�������������Һ���ܶ� | �ܵ�������Ȼ�����Һ�����ܵ����������Һ���ܶȽ�С��������ˮ |

 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д�����Ŀ���ҹ���ѧ�Һ�°�ĸ��˹���Ĵ����������գ������������Ƽ�����������̿ɼ�Ҫ��ʾ���£�
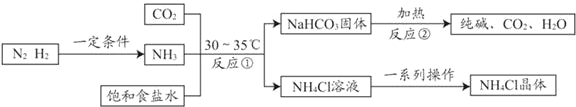
��֪NH4Cl�����ֽ⣬��ش��������⡣
��1�����������п�ѭ�����õ�������_____��дһ�֣���
��2����Ӧ���Ļ�ѧ����ʽ��_____��
��3���±��Ǽ��������ڲ�ͬ�¶��µ��ܽ��
���¶� | ��0�� | ��10�� | ��20�� | ��30�� | 40�� | 50�� | ��60�� | ��100�� | |
���ܽ��/g | ��NaCl | ��35.7 | ��35.8 | ��36.0 | ��36.3 | ��36.6 | ��37.0 | 37.3�� | ��39.8 |
��NH4HCO3 | ��11.9 | ��15.8 | ��21.0 | ��27.0 | �� | �� | �� | �� | |
��NaHCO3 | ��6.9 | ��8.2 | ��9.6 | ��11.1 | ��12.7 | ��14.5 | ��16.4 | �� | |
��NH4Cl | ��29.4 | ��33.3 | ��37.2 | ��41.4 | ��45.8 | 50.4�� | ��55.5 | 77.3 | |
�����������ݿ�֪����Ӧ����NaHCO3��Ϊ����������ԭ����_____��
���������еõ���NH4Cl��Һ��һ����_____���ʣ���NH4Cl��Һ�л��NH4Cl�����һϵ�в�����Ҫ��������Ũ����_____��_____��
����Ŀ����ͼ��������������ʾ���������ʼ��ܷ�����Ӧ����ͷ��������ʾ�������ʿ�ת��Ϊ��һ�����ʣ������мס��ҡ��������������ʲ����϶�Ӧת����ϵ������( )
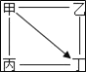
��� | �� | �� | �� | �� |
A�� | Ca(OH)2 | HCl | CO2 | NaOH |
B�� | O2 | C | CO | CuO |
C�� | HCl | Fe | CuO | CuCl2 |
D�� | HCl | Na2CO3 | AgNO3 | CaCl2 |
A. AB. BC. CD. D