题目内容
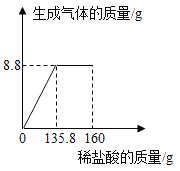
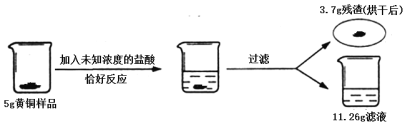
【题目】黄铜是Cu、Zn合金,为了测定某黄铜中锌的含量和一瓶未知浓度的盐酸质量分数(如图),现取5g黄铜将其打成粉末,并做如下实验。则:

(1)上述反应的化学方程式为_______________;
(2)列出反应生成氢气质量(X)的比例式是____________;
(3)黄铜中铜的质量分数为_________;
(4)测定未知盐酸中溶质的质量分数为_________。
【答案】Zn+2HCl===ZnCl2+H2↑ ![]() 或
或![]() 74% 14.6%
74% 14.6%
【解析】
(1)黄铜是Cu、Zn合金,在金属活动顺序中,铜排在氢之后,不能与盐酸反应,锌排在氢之前,能与盐酸反应生成氯化锌和氢气,反应的化学方程式为:Zn+2HCl===ZnCl2+H2↑;
(2)黄铜中加入盐酸充分反应后,剩余3.7g残渣,根据第(1)题分析可知,3.7g为铜的质量,则参加反应的锌的质量=5g-3.7g=1.3g;
设:反应生成的氢气质量为x。
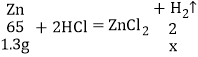
![]() 或
或![]() x=0.04g;
x=0.04g;
(3)黄铜中铜的质量分数=![]() ;
;
(4)设:未知盐酸中溶质的质量为y。
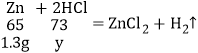
![]() y=1.46g;
y=1.46g;
根据质量守恒定律可知,参加反应的盐酸质量=11.26g+0.04g-1.3g=10g;未知盐酸中溶质的质量分数=![]() 。
。

【题目】火锅是我国独创的美食,历史悠久。火锅常用的一种燃料是固体酒精。某化学兴趣小组的同学对“固体酒精”产生了好奇,对其成分进行探究。请你回答下列问题。
(查阅资料)
a.固体酒精也被称为"酒精块"或固体燃料块。固体酒精并不是固体状态的酒精而是将酒精、硬脂酸和氢氧化钠按一定的质量比混合制成。
b.酒精的化学式为C2H5OH;
c.氯化钡、氯化钠溶液均呈中性。
d. BaCl2+Na2CO3=BaCO3↓+2NaCl 生成的BaCO3为白色固体
(提出问题)
(1)酒精的化学式与NaOH相比,都有“OH”,那么酒精的水溶液是不是显碱性?
(2)固体酒精中的氢氧化钠是否变质及变质的程度如何?
(实验探究1)酒精的水溶液是不是显碱性
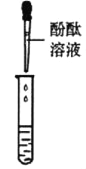
同学们取少量酒精溶液于试管中,滴加紫色石蕊溶液,未观察到紫色石蕊变为蓝色,说明酒精溶液_______(填“显”或“不显”)碱性。
(实验探究2)固体酒精中的氢氧化钠是否变质及变质的程度如何
①固体酒精中的氢氧化钠是否变质,同学们先取少量固体酒精于烧杯中,加入足量水溶解后滴加足量的稀盐酸,观察到__________现象,说明氢氧化钠已变质.请写出氢氧化钠在空气中变质的化学方程式______________。
②为进一步确定氢氧化钠的变质程度,分组进行探究。
甲组同学取烧杯上层清液于两支试管中,按如图所示进行实验。
实验方案 |
|
|
实验现象 | 溶液变红 | 产生__ |
实验结论 | 清液中有氢氧化钠 | 清液中有碳酸钠 |
乙组同学认为甲组实验不能证明清液中一定有氢氧化钠,理由是__。他们另取烧杯中上层清液,加足量氯化钡溶液,充分反应后,静置,取上层清液,滴加酚酞溶液,酚酞溶液变红。
(反思交流)乙组实验中加足量氯化钡溶液的目的是________。
(实验结论]小组同学经过讨论,一致认为该固体酒精中的氢氧化钠部分变质。
【题目】我国化学家侯德榜改革了国外的纯碱生产工艺,发明了联合制碱法,其生产流程可简要表示如下:
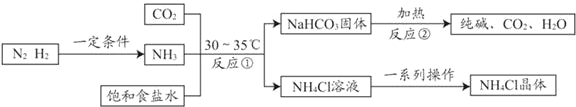
已知NH4Cl受热易分解,请回答下列问题。
(1)上述流程中可循环利用的物质是_____(写一种);
(2)反应②的化学方程式是_____;
(3)下表是几种物质在不同温度下的溶解度
温度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ | |
溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | ﹣ | ﹣ | ﹣ | ﹣ | |
NaHCO3 | 6.9 | 8.2 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | ﹣ | |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.5 | 77.3 | |
分析表中数据可知,反应①中NaHCO3作为固体析出的原因是_____;
上述流程中得到的NH4Cl溶液中一定有_____杂质,从NH4Cl溶液中获得NH4Cl晶体的一系列操作主要包括蒸发浓缩、_____、_____。