题目内容
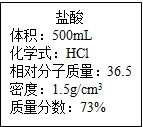
 如图是配制好的盐酸溶液的标签,请根据标签上的文字信息,进行计算:
如图是配制好的盐酸溶液的标签,请根据标签上的文字信息,进行计算:(1)该盐酸溶液中溶剂质量为
90
90
g;(2)某纯碱样品中含有少量氯化钠.为测定样品中碳酸钠的质量分数,现称取该样品11g,放入烧杯中加水完全溶解后滴加上述配制的盐酸溶液至完全反应,最后测得生成气体的质量为4.4g.计算:
①纯碱样品中碳酸钠的质量分数(结果精确到0.1%);
②用去盐酸溶液的质量是多少g?
分析:(1)利用溶质质量=溶液质量×溶质的质量分数,再根据溶剂质量=溶液质量-溶质质量即可求得溶剂的质量.
(2)根据碳酸钠和盐酸反应的化学方程式,已知二氧化碳的质量为4.4g,可求出参加反应的碳酸钠的质量和氯化氢的质量.从而求出纯碱样品中碳酸钠的质量分数.
(2)根据碳酸钠和盐酸反应的化学方程式,已知二氧化碳的质量为4.4g,可求出参加反应的碳酸钠的质量和氯化氢的质量.从而求出纯碱样品中碳酸钠的质量分数.
解答:解:(1)根据题意,100g溶质质量分数为10%的盐酸溶液中溶质的质量为:100g×10%=10g,所含溶剂的质量为100g-10g=90g.
(2)设碳酸钠的质量为x,消耗掉的盐酸溶液的质量为y
Na2CO3+2 HCl=2NaCl+H2O+CO2↑
106 73 44
x y×10% 4.4g
=
x=10.6g
=
y=73g
纯碱样品中碳酸钠的质量分数为
×100%=96.4%
答:①纯碱样品中碳酸钠的质量分数为96.4%
②用去盐酸溶液的质量是为73g
故答案为:(1)90 (2)①96.4% ②73g
(2)设碳酸钠的质量为x,消耗掉的盐酸溶液的质量为y
Na2CO3+2 HCl=2NaCl+H2O+CO2↑
106 73 44
x y×10% 4.4g
| 106 |
| x |
| 44 |
| 4.4g |
| 73 |
| y×10% |
| 44 |
| 4.4g |
纯碱样品中碳酸钠的质量分数为
| 10.6g |
| 11g |
答:①纯碱样品中碳酸钠的质量分数为96.4%
②用去盐酸溶液的质量是为73g
故答案为:(1)90 (2)①96.4% ②73g
点评:本题难度不是很大,掌握溶液组成的有关计算、利用化学方程式进行计算的方法是正确解答本题的关键.

练习册系列答案
相关题目
 实验室有一瓶浓盐酸,瓶上标签内容如图所示,请你根据标签上提供的数据解答下列问题:
实验室有一瓶浓盐酸,瓶上标签内容如图所示,请你根据标签上提供的数据解答下列问题:
 实验室有一瓶浓盐酸,瓶上标签内容如图所示,请你根据标签上提供的数据解答下列问题:
实验室有一瓶浓盐酸,瓶上标签内容如图所示,请你根据标签上提供的数据解答下列问题: