题目内容
将Na2CO3和NaCl固体混合物22.3g放入烧杯中,加入182.1g稀盐酸恰好完全反应.待没有气泡溢出后,称量烧杯中剩余物质总质量为200g.请计算:
(1)生成二氧化碳的质量是_________ ;
(2)求所得溶液中溶质的质量分数是多少?
(1)生成二氧化碳的质量是_________ ;
(2)求所得溶液中溶质的质量分数是多少?
(1)4.4g (2)11.7%
试题分析:(1)反应生成二氧化碳的质量=22.3g+182.1g﹣200g=4.4g;故填:4.4g;
(2)设碳酸钠的质量为x,生成氯化钠的质量为y
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
x y 4.4g
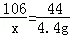
x=10.6g
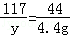
y=11.7g
所得溶液中溶质的质量分数=
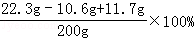 =11.7%
=11.7%答:所得溶液中溶质的质量分数为11.7%.
点评:根据质量守恒定律,反应后所得溶液的质量=固体混合物的质量+稀盐酸的质量﹣生成二氧化碳气体的质量.

练习册系列答案
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目



 水+氧气
水+氧气