题目内容
【题目】根据要求回答问题。
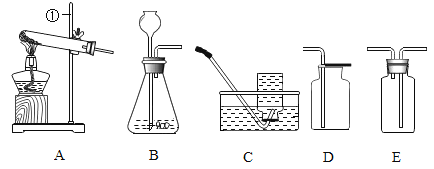
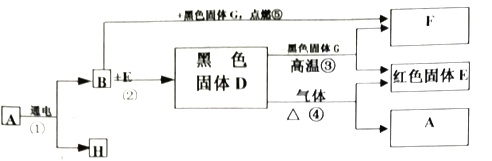
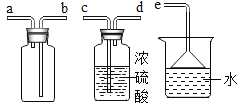
(1)写出仪器①的名称____________。
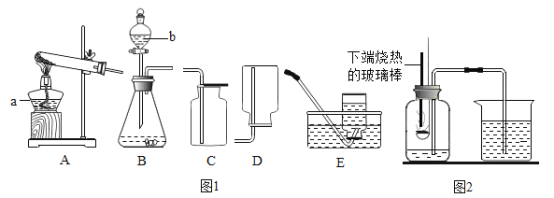
(2)用氯酸钾和二氧化锰制取氧气的符号表达式为_____________,该反应属于___________。(填基本反应类型)二氧化锰的作用是_______________。用装置C收得的氧气不纯,可能的原因是_______________。若用装置A装高锰酸钾制取氧气,则需要补充___________,其反应的符号表达式_______________。若要收集到较纯净的氧气,其收集装置应选___________ (填字母)。
(3)用向上排空气法收集到的气体,检验是否为氧气的操作是_______________。
(4)通常状态下,HCl是一种无色有刺激性气味的气体,密度比空气大,极易溶于水形成盐酸。用如图所示装置收集一瓶干燥的HCl,装置的导管按气流方向连接的顺序是:气体→_____→_____→_____→_____→e(填字母)。
(5)为了探究气体氨气(NH3) 的某些性质,小雨同学查阅了有关资料,知道具有碱性的物质可以使无色酚酞溶液变红;然后依次做了以下实验。
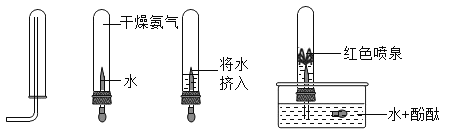
由以上实验,得出氨气的物理性质有_____________、_____________。
(6)为验证可燃物燃烧需要氧气,某同学利用中间凹陷的软质塑料瓶设计如下实验。已知稀盐酸与石灰石可发生反应生成二氧化碳。
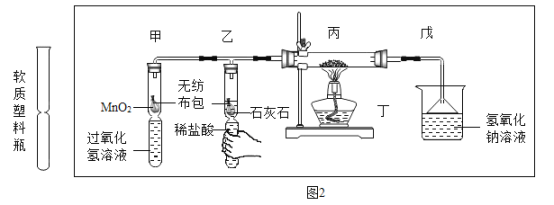
I甲着发生反应的符号表达式为___________,要使甲中反应发生的操作为____________。
II实验步骤:先捏住乙处瓶身一段时间(如图所示),后点燃丁处酒精灯,观察到丙处无显变化;放开乙处瓶身,___________(填具体操作),丙中红磷燃烧,产生白烟。
结论:物质燃烧需要氧气。实验中,先捏住乙处瓶身一段时间的目的是________。
III戊中氢氧化钠溶液可吸收污染物五氧化二磷,生成磷酸钠(Na3PO4)和水,反应的符号表达式为__________。
【答案】铁架台 ![]() 分解反应 催化作用 导管口一有气泡冒出就开始收集或集气瓶内留有气泡等 管口应塞一小团棉花
分解反应 催化作用 导管口一有气泡冒出就开始收集或集气瓶内留有气泡等 管口应塞一小团棉花 ![]() C 将带火星木条放在集气瓶口,木条复燃,氧气已满 c d b a 易溶于水 密度小于空气
C 将带火星木条放在集气瓶口,木条复燃,氧气已满 c d b a 易溶于水 密度小于空气 ![]() 捏放软塑料瓶下端 捏住甲处瓶身一段时间 排除装置的空气与后面要做的实验形成对比
捏放软塑料瓶下端 捏住甲处瓶身一段时间 排除装置的空气与后面要做的实验形成对比 ![]()
【解析】
(1)根据实验室常用仪器的名称和用途进行分析;
(2)根据反应物、生成物和反应条件写符号表达式;根据反应的特征、二氧化锰的作用、制取气体的注意事项进行分析;
(3)氧气具有助燃性,用带火星的木条放在瓶口验满;
(4)根据HCl气体的性质进行分析解答。
(5)根据氨气物理性质进行分析解答。
(6)根据反应物、生成物和反应条件写符号表达式;根据燃烧的条件进行分析。
(1)根据实验室常用仪器可知,该仪器为铁架台;故填:铁架台。
(2)氯酸钾在二氧化锰的催化作用下加热生成氯化钾和氧气,该反应的符号表达式为:![]() ;符合“一变多”的特点,是分解反应;在这个反应中二氧化锰起催化作用;用装置C收得的氧气不纯,可能的原因是:导管口一有气泡冒出就开始收集或集气瓶内留有气泡等;A装置可制取原料是固态的气体,但用高锰酸钾来制取氧气,要注意防止加热时高锰酸钾粉末进入导管,管口应塞一小团棉花,加热时高锰酸钾粉末进入导管 ;该反应的符号表达式为:
;符合“一变多”的特点,是分解反应;在这个反应中二氧化锰起催化作用;用装置C收得的氧气不纯,可能的原因是:导管口一有气泡冒出就开始收集或集气瓶内留有气泡等;A装置可制取原料是固态的气体,但用高锰酸钾来制取氧气,要注意防止加热时高锰酸钾粉末进入导管,管口应塞一小团棉花,加热时高锰酸钾粉末进入导管 ;该反应的符号表达式为:![]() ;若要收集到较纯净的氧气,其收集装置应选C,这是因为利用排水法收集的气体比用排空气法收集的气体更纯净;故填:
;若要收集到较纯净的氧气,其收集装置应选C,这是因为利用排水法收集的气体比用排空气法收集的气体更纯净;故填:![]() ;分解反应;催化作用;导管口一有气泡冒出就开始收集或集气瓶内留有气泡等;管口应塞一小团棉花;
;分解反应;催化作用;导管口一有气泡冒出就开始收集或集气瓶内留有气泡等;管口应塞一小团棉花;![]() ; C。
; C。
(3)将带火星木条横放瓶口,若木条复燃则已收集满。故填:将带火星木条横放瓶口,若木条复燃则已收集满。
(4)通常状态下,HCl是一种无色有刺激性气味的有毒气体,密度比空气大,极易溶于水形成盐酸。用如图所示装置收集一瓶干燥的HCl,装置的导管按气流方向连接的顺序是:cdbae。故填:cdba。
(5)实验室制取氨气的反应物是固体,反应条件是加热,收集氨气的方法是向下排空气法,挤入水后会形成红色喷泉,推断出氨气的物理性质有:易溶于水,密度小于空气。故填:易溶于水,密度小于空气。
(6)I甲着发生反应为过氧化氢分解,故其符号表达式为![]() ,要使甲中反应发生的操作为捏放软塑料瓶下端。II:根据控制变量实验法的方法可知,先捏住乙处瓶身一段时间,后点燃丁处酒精灯,观察到丙处无明显变化;放开乙处瓶身,捏住甲处瓶身一段时间,丙中红磷燃烧,产生白烟;实验中,捏住乙处瓶身一段时间的目的是排除装置的空气与后面要做的实验形成对比;III.五氧化二磷和氢氧化钠反应生成磷酸钠和水,反应的符号表达式为:
,要使甲中反应发生的操作为捏放软塑料瓶下端。II:根据控制变量实验法的方法可知,先捏住乙处瓶身一段时间,后点燃丁处酒精灯,观察到丙处无明显变化;放开乙处瓶身,捏住甲处瓶身一段时间,丙中红磷燃烧,产生白烟;实验中,捏住乙处瓶身一段时间的目的是排除装置的空气与后面要做的实验形成对比;III.五氧化二磷和氢氧化钠反应生成磷酸钠和水,反应的符号表达式为:![]() ;故应填:
;故应填:![]() ;捏放软塑料瓶下端;捏住甲处瓶身一段时间;排除装置的空气与后面要做的实验形成对比;
;捏放软塑料瓶下端;捏住甲处瓶身一段时间;排除装置的空气与后面要做的实验形成对比;![]() 。
。

【题目】空气是宝贵的自然资源,其组成如下表。
空气组成 | X | O2 | 稀有气体 | CO2 | 其它 |
体积分数 | 78% | Y | 0.94% | 0.03% | 0.03% |
如图是以空气等为原料合成尿素[CO(NH2)2]的流程(部分产物略去)。请按要求回答相关问题:
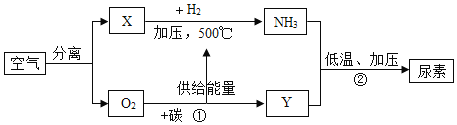
(1)X 的符号是______ Y 的值是_______
(2)上述流程中煤发生的变化属于_______(填“物理变化”或“化学变化”)
(3)分离空气制取氧气的常用方法有以下两种。
Ⅰ.分离液态空气制氧气,原理是利用液氧和液氮的______不同。
Ⅱ.分子筛分离。分子筛是一种内部分布有均匀微小孔径的固体,通过特制的分子筛把空气中的氧分子吸入孔穴而与其它分子分离,则分子大小:X ______O2(选填“大于“、“等子”、“小于)
(4)结合流程和所学知识可以预测:化学反应中物质发生变化的同时一定还伴随有______(选填“状态”、 “能量”、“原子”、“压强”)变化。