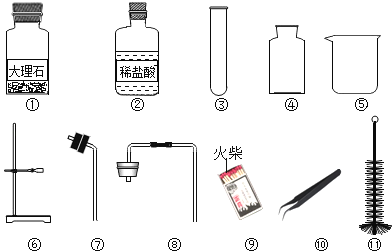
题目内容
【题目】科学家在合成超导材料时,偶然制得了再自然界中未发现的紫色化合物BaCuSi2O6
(1)该化合物由____种元素组成,它的相对分子质量为________
(2)其中Si元素位于元素周期表第___周期,Si元素在本化合物中质量分数是_____(结果保留0.01),化合价为___。
(3)写出相同价态硅的氧化物的化学式______
【答案】4 353 3 15.86% +4 SiO2
【解析】
(1)根据紫色化合物(BaCuSi2O6)化学式可知,该化合物是由钡、铜、硅、氧四种元素组成的;它的相对分子质量=137+64+28×2+16×6=353;
(2)Si的原子序数为14,根据核外电子排布规律可知,原子核外共有3个电子层,在元素周期表中,周期数与电子层数相同,Si元素位于元素周期表第3周期,Si元素在该化合物中质量分数=![]() ;在该化合物中,钡元素显+2价,Cu为+2价,氧元素显-2价,设:硅元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+2)+(+2)+2x+(-2)×6=0,则x=+4;
;在该化合物中,钡元素显+2价,Cu为+2价,氧元素显-2价,设:硅元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+2)+(+2)+2x+(-2)×6=0,则x=+4;
(3)硅元素显+4价,氧元素显-2价,其氧化物的化学式为:SiO2。

【题目】在一定密闭容器内有氧气、二氧化碳、水蒸气及一种未知物质M,在一定条件下充分反应。测得反应前后各物质的质量如下表:
物质 | 氧气 | 二氧化碳 | 水蒸气 | M |
反应前质量/g | 100 | 1 | 1 | 46 |
反应后质量/g | 4 | 89 | 55 | x |
(1)根据质量守恒定律,你认为x的值应为_____________。
(2)未知物质M一定含有的元素为______________________。
(3)已知未知物质M的相对分子质量为46,推出其化学式为_____________。
(4)该反应的化学方程式为______________________________。