题目内容
【题目】我国新版《环境空气质量标准》增加了关于臭氧(O3)的控制标准:以日8小时内浓度来监测,臭氧8小时浓度日平均值一级为100微克/立方米,二级为160微克/立方米。请阅读下列提供的资讯信息,回答相关问题:
(资讯1)夏季持续高温,阳光灿烂,臭氧8小时浓度开始出现直线上升超高运行,超标的臭氧是无形杀手。
(资讯2)臭氧在常温常压下是淡蓝色气体,稳定性极差,可自行分解为氧气。臭氧在空气中达到一定浓度可刺激呼吸道。长期吸入大量臭氧会引起口干舌燥,咳嗽等不适症状,还可能诱发中毒性肺气肿。
(资讯3)大气中臭氧浓度超标的原因是:在静风条件下强烈的阳光就成为氮氧化物的催化剂,从而推高了臭氧浓度,形成污染。
(1)氧气和臭氧的化学性质存在差异的原因在于__________,请写出臭氧“自行分解”的化学方程式为____________,
(2)若氮氧化物假定为二氧化氮,强光条件下促使其生成臭氧和氮气,请写出该反应的化学方程式为______________,则该反应的基本类型为___________。
(3)复印机在工作时,会因高压放电产生一定浓度的臭氧。下列说法正确的是____(填序号)
①臭氧是由三个氧原子构成的
②氧气和臭氧都是由氧元素组成的单质
③氧气与臭氧的性质相同
④氧气转化为臭氧是化学变化
⑤由臭氧溶入水中制成的臭氧水属于混合物
(4)请你提出一些有效减少和应对产生臭氧污染的保护措施(至少一点)____________。
【答案】分子构成(种类)不同 2O3=3O2 6NO2![]() 4O3 +3N2 分解反应 ②④⑤ 防治挥发性有机物污染;减少排放氮氧化物、碳氢化合物等;臭氧超标天气应减少户外活动;制定出长期控制战略纳入减排约束性指标等
4O3 +3N2 分解反应 ②④⑤ 防治挥发性有机物污染;减少排放氮氧化物、碳氢化合物等;臭氧超标天气应减少户外活动;制定出长期控制战略纳入减排约束性指标等
【解析】
(1)两种物质的性质存在差异的原因在于其分子构成(种类)不同。根据题意,臭氧自行分解的产物为氧气,所以化学方程式为2O3=3O2。
(2)根据题意,反应物为二氧化氮,产物臭氧和氮气,反应条件为强光,故化学方程式为6NO2![]() 4O3 +3N2。由上述反应为一种物质生成两种或多种物质的反应,属于分解反应。
4O3 +3N2。由上述反应为一种物质生成两种或多种物质的反应,属于分解反应。
(3)①臭氧是由臭氧分子构成的,不符合题意;
②氧气和臭氧都是由氧元素组成,且都是单质,符合题意;
③构成氧气与臭氧两种物质的分子不同,因此它们的性质不同,不符合题意;
④氧气转化为臭氧的过程,有新物质的生成,属于化学变化,符合题意;
⑤臭氧溶入水制成的臭氧水中有两种物质,分别为臭氧和水,属于混合物,符合题意;
故选②④⑤。
(4)臭氧污染多为人类生产活动造成的,可从此方面作答,如防治挥发性有机物污染;减少排放氮氧化物、碳氢化合物等;臭氧超标天气应减少户外活动;制定出长期控制战略纳入减排约束性指标等。

 轻松暑假总复习系列答案
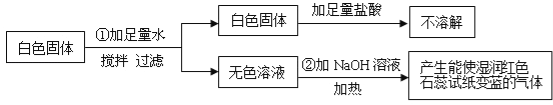
轻松暑假总复习系列答案【题目】探究题。化学兴趣小组的同学用如图所示装置进行中和反应实验,请你参与下列探究:
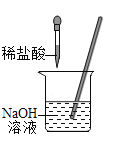
(1)为确定稀盐酸与氢氧化钠溶液是否刚好完全中和,小华取出一定量反应后的溶液于一支试管中,向其中滴入几滴无色酚酞试液,振荡,观察到酚酞试液不变色,于是他得出“两种物质已恰好完全中和”的结论。
①写出该中和反应的化学方程式:___________________。
②小亮认为小华得出的结论不完整,他认为除了“恰好中和”外,还有第二种可能性,这种可能性是__________________。
③请你另外设计一个实验,探究上述烧杯中的溶液是否恰好完全中和,填写下表(选择甲、乙中的一个作答):
实验 | 实验方法 | 实验现象 | 实验结论 |
甲 | _______ | _______ | 恰好中和 |
乙 | ______ | _________ | 第二种可能性 |
(2)玲玲同学在实验时,发现烧杯中有少量的气泡产生,她经过分析认为可能的原因是氢氧化钠溶液变质(提示:碳酸钠溶液呈碱性)。为了检验氢氧化钠溶液是否变质,玲玲提出用酚酞试液检验,你认为该方法________(填“正确”或“不正确”),理由是_____________。
(3)中和反应在实际生产、生活中应用极为广泛,请你举一具体实例加以说明:____________。