题目内容
实验室常用下列装置研究气体的制取和性质,根据所学知识回答下列问题.
(1)写出实验室制取氧气的一个化学方程式 .利用该反应制取氧气,发生装置应选 (填序号,下同).
(2)一氧化氮气体难溶于水,在空气中容易发生下列反应2NO+O2═2NO2,则收集一氧化氮气体应采用的装置是(填序号) _.
(3)按图F作细铁丝在氧气中燃烧的实验,我观察到的现象有 (只答一条),其相关的化学方程式是 .
(4)实验室里将制得的二氧化碳气体通入澄清石灰水中,始终未出现浑浊现象,可能的原因是 .
(5)NaOH潮解后极易与空气中的CO2反应生成碳酸钠而变质,为测定实验室一瓶放置很久的烧碱中NaOH的含量,某同学取适量的烧碱样品,溶于一定量的水中得到100g溶液,放入B装置中,然后将分液漏斗中的稀硫酸逐滴加入到锥形瓶中,直到不再产生气体为止,这时用去的稀硫酸的质量为100g,最后称量锥形瓶中溶液质量为195.6g.请计算:
①反应产生的CO2的质量为 .
②若所取烧碱样品为50.0g,则样品中NaOH的质量分数是多少?

(1)写出实验室制取氧气的一个化学方程式
(2)一氧化氮气体难溶于水,在空气中容易发生下列反应2NO+O2═2NO2,则收集一氧化氮气体应采用的装置是(填序号)
(3)按图F作细铁丝在氧气中燃烧的实验,我观察到的现象有
(4)实验室里将制得的二氧化碳气体通入澄清石灰水中,始终未出现浑浊现象,可能的原因是
(5)NaOH潮解后极易与空气中的CO2反应生成碳酸钠而变质,为测定实验室一瓶放置很久的烧碱中NaOH的含量,某同学取适量的烧碱样品,溶于一定量的水中得到100g溶液,放入B装置中,然后将分液漏斗中的稀硫酸逐滴加入到锥形瓶中,直到不再产生气体为止,这时用去的稀硫酸的质量为100g,最后称量锥形瓶中溶液质量为195.6g.请计算:
①反应产生的CO2的质量为
②若所取烧碱样品为50.0g,则样品中NaOH的质量分数是多少?
考点:常用气体的发生装置和收集装置与选取方法,氧气的化学性质,实验室制取氧气的反应原理,二氧化碳的实验室制法,根据化学反应方程式的计算
专题:常见气体的实验室制法、检验、干燥与净化
分析:(1)可以用过氧化氢分解制取氧气,该反应不需要加热;
(2)一氧化氮不溶于水,能和空气中的氧气反应,收集时只能用排水法;
(3)铁在氧气中能够剧烈地燃烧,火星四射,放出大量的热,生成黑色固体;
(4)根据实验室里将制得的二氧化碳气体通入澄清石灰水中,始终未出现浑浊现象,可能的原因是:装置气密性不好,产生的二氧化碳散逸到空气中了或盐酸具有挥发性,挥发出来的氯化氢气体进入石灰水中形成盐酸,溶解了生成的碳酸钙沉淀解答;
(5)
①根据质量守恒定律,反应过程中所生成的气体的质量等于反应前后溶液质量的减少;
②样品中NaOH的质量分数等于样品中NaOH的质量除以样品的总质量,所以我们可以根据上一步所求得氧气的质量,根据质量守恒定律,求得样品中NaOH的质量,而后再求样品中NaOH的质量分数.
(2)一氧化氮不溶于水,能和空气中的氧气反应,收集时只能用排水法;
(3)铁在氧气中能够剧烈地燃烧,火星四射,放出大量的热,生成黑色固体;
(4)根据实验室里将制得的二氧化碳气体通入澄清石灰水中,始终未出现浑浊现象,可能的原因是:装置气密性不好,产生的二氧化碳散逸到空气中了或盐酸具有挥发性,挥发出来的氯化氢气体进入石灰水中形成盐酸,溶解了生成的碳酸钙沉淀解答;
(5)
①根据质量守恒定律,反应过程中所生成的气体的质量等于反应前后溶液质量的减少;
②样品中NaOH的质量分数等于样品中NaOH的质量除以样品的总质量,所以我们可以根据上一步所求得氧气的质量,根据质量守恒定律,求得样品中NaOH的质量,而后再求样品中NaOH的质量分数.
解答:解:
(1)如果用双氧水和二氧化锰制氧气就不需要加热,过氧化氢在二氧化锰的催化作用下能生成水和氧气,化学方程式为:2H2O2
2H2O+O2↑,该反应不需要加热,可以用B装置制取;
(2)一氧化氮不溶于水,能和空气中的氧气反应,收集时只能用排水法,故填:E.
(3)铁在氧气中能够剧烈地燃烧,火星四射,放出大量的热,生成黑色固体,氧气与铁反应生成的四氧化三铁,反应的化学方程式为:
(4)实验室里将制得的二氧化碳气体通入澄清石灰水中,始终未出现浑浊现象,可能的原因是:装置气密性不好,产生的二氧化碳散逸到空气中了或盐酸具有挥发性,挥发出来的氯化氢气体进入石灰水中形成盐酸,溶解了生成的碳酸钙沉淀;
(5)
①根据质量守恒定律,反应前后溶液质量的减少就等于反应过程中所生成的气体的质量,所以反应产生的CO2的质量100g+100g-195.6g=4.4g.
②设所取样品中含有Na2CO3的质量为x.
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 44
x 4.4g
=
x=10.6g
则烧碱样品中NaOH的质量分数是
×100%=78.8%
答案:
(1)2H2O2
2H2O+O2↑ B
(2)E
(3)火星四射 3Fe+2O2
Fe3O4
(4)装置气密性不好,产生的二氧化碳散逸到空气中了
(5)
①4.4
②则烧碱样品中NaOH的质量分数是78.8%
(1)如果用双氧水和二氧化锰制氧气就不需要加热,过氧化氢在二氧化锰的催化作用下能生成水和氧气,化学方程式为:2H2O2
| ||
(2)一氧化氮不溶于水,能和空气中的氧气反应,收集时只能用排水法,故填:E.
(3)铁在氧气中能够剧烈地燃烧,火星四射,放出大量的热,生成黑色固体,氧气与铁反应生成的四氧化三铁,反应的化学方程式为:
(4)实验室里将制得的二氧化碳气体通入澄清石灰水中,始终未出现浑浊现象,可能的原因是:装置气密性不好,产生的二氧化碳散逸到空气中了或盐酸具有挥发性,挥发出来的氯化氢气体进入石灰水中形成盐酸,溶解了生成的碳酸钙沉淀;
(5)
①根据质量守恒定律,反应前后溶液质量的减少就等于反应过程中所生成的气体的质量,所以反应产生的CO2的质量100g+100g-195.6g=4.4g.
②设所取样品中含有Na2CO3的质量为x.
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 44
x 4.4g
| 106 |
| 44 |
| x |
| 4.4g |
x=10.6g
则烧碱样品中NaOH的质量分数是
| 50g-10.6g |
| 50g |
答案:
(1)2H2O2
| ||
(2)E
(3)火星四射 3Fe+2O2
| ||
(4)装置气密性不好,产生的二氧化碳散逸到空气中了
(5)
①4.4
②则烧碱样品中NaOH的质量分数是78.8%
点评:本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和铁丝燃烧的现象等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.

练习册系列答案
相关题目
下列有关催化剂的说法中不正确的是( )
| A、催化剂可以改变某些化学反应的速率 |
| B、催化剂在化学反应前后质量与化学性质均不改变 |
| C、催化剂可以提高反应生成物的质量 |
| D、在双氧水溶液加入二氧化锰不是反应物,而是催化剂 |
化学实验成功的关键是( )
①严谨的科学态度 ②合理的实验步骤 ③正确的操作方法.
①严谨的科学态度 ②合理的实验步骤 ③正确的操作方法.
| A、① | B、①② | C、②③ | D、①②③ |
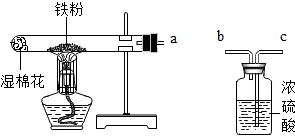 某校化学兴趣小组的同学在阅读资料时发现,18世纪末,法国科学家拉瓦锡曾经做了这样一个实验:让水蒸气通过一根烧红的铁枪管,生成了一种气体.同学们对这个实验很感兴趣:难道红热的铁能与水蒸气反应?生成的气体又是什么?带着这些疑问,他们设计了如图所示的装置进行探究.
某校化学兴趣小组的同学在阅读资料时发现,18世纪末,法国科学家拉瓦锡曾经做了这样一个实验:让水蒸气通过一根烧红的铁枪管,生成了一种气体.同学们对这个实验很感兴趣:难道红热的铁能与水蒸气反应?生成的气体又是什么?带着这些疑问,他们设计了如图所示的装置进行探究.