题目内容
将6.8g含杂质的锌粒,加入到盛有50.0g稀硫酸的烧杯中(杂质不溶于水,也不与稀硫酸反应),充分反应后,称得烧杯内物质的总质量为56.6g,试计算:
(1)生成氢气的质量
(2)锌粒中所含锌的质量分数(精确到0.1%).
(1)生成氢气的质量
(2)锌粒中所含锌的质量分数(精确到0.1%).
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:反应前后的质量差即为反应生成氢气的质量,根据氢气的质量可以计算锌的质量,进一步可以计算锌的质量分数.
解答:解:(1)生成氢气的质量为:6.8g+50.0g-56.6g=0.2g,
故填:0.2g.
(2)设锌的质量为x,
Zn+H2SO4═ZnSO4+H2↑,
65 2
x 0.2g
=
,
x=6.5g,
锌粒中所含锌的质量分数为:
×100%=95.6%,
答:锌粒中所含锌的质量分数为95.6%.
故填:0.2g.
(2)设锌的质量为x,
Zn+H2SO4═ZnSO4+H2↑,
65 2
x 0.2g
| 65 |
| x |
| 2 |
| 0.2g |
x=6.5g,
锌粒中所含锌的质量分数为:
| 6.5g |
| 6.8g |
答:锌粒中所含锌的质量分数为95.6%.
点评:本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
下列图中是初中化学的几个实验操作,其中正确的是( )
A、 点燃酒精灯 |
B、 称量10.05g固体 |
C、 加热液体 |
D、 量取9.5mL液体 |
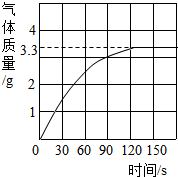 长期反复使用的盛放石灰水的试剂瓶内有一层白色固体,主要成分是碳酸钙.为了充分洗涤又不造成浪费做如下探究:刮下10g白色固体,加入足量质量分数为10%的盐酸,产生CO2气体的情况如图所示.请回答:
长期反复使用的盛放石灰水的试剂瓶内有一层白色固体,主要成分是碳酸钙.为了充分洗涤又不造成浪费做如下探究:刮下10g白色固体,加入足量质量分数为10%的盐酸,产生CO2气体的情况如图所示.请回答: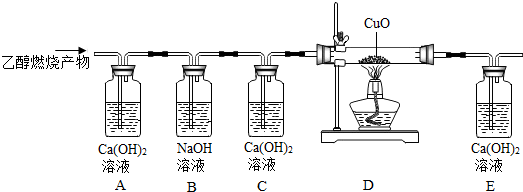
 探究物质燃烧的条件的实验装置如图所示.
探究物质燃烧的条件的实验装置如图所示.