题目内容
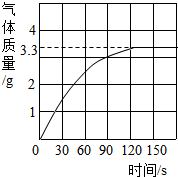 长期反复使用的盛放石灰水的试剂瓶内有一层白色固体,主要成分是碳酸钙.为了充分洗涤又不造成浪费做如下探究:刮下10g白色固体,加入足量质量分数为10%的盐酸,产生CO2气体的情况如图所示.请回答:
长期反复使用的盛放石灰水的试剂瓶内有一层白色固体,主要成分是碳酸钙.为了充分洗涤又不造成浪费做如下探究:刮下10g白色固体,加入足量质量分数为10%的盐酸,产生CO2气体的情况如图所示.请回答:(1)10g白色固体与盐酸反应后生成的二氧化碳最多是
(2)假设白色固体中含有的其他杂质不与盐酸反应,那么溶解10g这种白色固体需要这种盐酸的质量是多少(最后结果保留一位小数).
考点:根据化学反应方程式的计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)由图可知,120s后恰好完全反应,放出二氧化碳3.3g;
(2)根据反应的化学方程式,由生成二氧化碳的质量计算碳酸钙完全反应所消耗HCl的质量,由所计算HCl质量与溶液的质量分数,利用溶质质量分数公式,计算所需稀盐酸的质量.
(2)根据反应的化学方程式,由生成二氧化碳的质量计算碳酸钙完全反应所消耗HCl的质量,由所计算HCl质量与溶液的质量分数,利用溶质质量分数公式,计算所需稀盐酸的质量.
解答:解:
(1)由图可知,120s后恰好完全反应,放出二氧化碳3.3g;
(2)设放出3.3g二氧化碳消耗HCl的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
73 44
x 3.3g
=
x=5.475g
至少需要质量分数为10%的盐酸的质量:
=54.75g≈54.8g
答案:
(1)3.3g
(2)溶解10g这种白色固体需要这种盐酸的质量是54.8g.
(1)由图可知,120s后恰好完全反应,放出二氧化碳3.3g;
(2)设放出3.3g二氧化碳消耗HCl的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
73 44
x 3.3g
| 73 |
| 44 |
| x |
| 3.3g |
x=5.475g
至少需要质量分数为10%的盐酸的质量:
| 5.475g |
| 10% |
答案:
(1)3.3g
(2)溶解10g这种白色固体需要这种盐酸的质量是54.8g.
点评:分析变化曲线时,曲线的折点即恰好完全反应,此时放出气体的质量即最大质量.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
近年来黄金价格不断上涨,金的符号Au不能表示( )
| A、金单质 | B、金元素 |
| C、一个金分子 | D、一个金原子 |
化学上结构决定性质,与元素化学性质关系最密切的是原子的( )
| A、核内质子数 |
| B、相对原子质量 |
| C、核外电子总数 |
| D、最外层上电子数 |
 ”和“
”和“ ”分别表示两种不同的原子,如图所示是构成某些气体粒子的示意图,根据其组成特点回答(填序号)下列问题:
”分别表示两种不同的原子,如图所示是构成某些气体粒子的示意图,根据其组成特点回答(填序号)下列问题: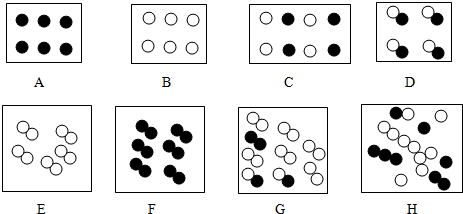
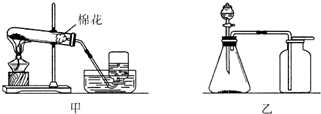 如图是实验室制取氧气的两种装置,请回答下列问题.
如图是实验室制取氧气的两种装置,请回答下列问题. 小明自制了一个“蜡烛抽水机”的实验装置,如图所示.他将一只塑料管完成∩形,一端插入硬制片,纸片与杯口密封(涂有凡士林),另一端插入右杯溶液中,点燃蜡烛,一段时间后蜡烛熄灭.这时左杯内气体压强将
小明自制了一个“蜡烛抽水机”的实验装置,如图所示.他将一只塑料管完成∩形,一端插入硬制片,纸片与杯口密封(涂有凡士林),另一端插入右杯溶液中,点燃蜡烛,一段时间后蜡烛熄灭.这时左杯内气体压强将