题目内容
黄铜是锌铜合金,在生活中被广泛应用,小斌同学为测定其组成,从冶金厂称取25.0g黄铜屑逐滴加入稀硫酸至黄铜屑的质量不再发生变化,一共用去稀硫酸80.0g,同时收集到气体4.49L(气体密度为0.089g/L),请计算:
(1)该黄铜片中铜的质量是多少?
(2)稀硫酸溶质的质量分数是多少?
(3)小斌将反应后剩余的固体置于坩埚中加热烘干后称量,发现质量大于上述计算所得单质铜的质量,你觉得其原因可能是 .
(1)该黄铜片中铜的质量是多少?
(2)稀硫酸溶质的质量分数是多少?
(3)小斌将反应后剩余的固体置于坩埚中加热烘干后称量,发现质量大于上述计算所得单质铜的质量,你觉得其原因可能是
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:(1)根据锌与硫酸反应的化学方程式和氢气的质量可以求出锌的质量,进而求得铜的质量;
(2)根据锌与硫酸反应的化学方程式和氢气的质量可以求出稀硫酸中溶质的质量,进而求质量分数;
(3)在将反应后剩余的固体置于坩埚中加热烘干过程中,有一部分铜与氧气反应生成氧化铜,导致质量增加.
(2)根据锌与硫酸反应的化学方程式和氢气的质量可以求出稀硫酸中溶质的质量,进而求质量分数;
(3)在将反应后剩余的固体置于坩埚中加热烘干过程中,有一部分铜与氧气反应生成氧化铜,导致质量增加.
解答:解:氢气的质量为:4.49L×0.089g/L=0.4g
设黄铜中Zn的质量为x,稀硫酸中溶质质量为y
Zn+H2SO4═ZnSO4+H2↑
65 98 2
x y 0.4g
=
=
x=13g,y=19.6g
(1)该黄铜片中铜的质量是:
×00%=48%;
答:该黄铜片中铜的质量是48%;
(2)稀硫酸溶质的质量分数是:
×100%=24.5%;
答:稀硫酸溶质的质量分数是24.5%;
(3)在将反应后剩余的固体置于坩埚中加热烘干过程中,有一部分铜与氧气反应生成氧化铜,导致质量增加;
故答案为:铜与氧气反应生成氧化铜.
设黄铜中Zn的质量为x,稀硫酸中溶质质量为y
Zn+H2SO4═ZnSO4+H2↑
65 98 2
x y 0.4g
| 65 |
| x |
| 98 |
| y |
| 2 |
| 0.4g |
x=13g,y=19.6g
(1)该黄铜片中铜的质量是:
| 25g-13g |
| 25g |
答:该黄铜片中铜的质量是48%;
(2)稀硫酸溶质的质量分数是:
| 19.6g |
| 80g |
答:稀硫酸溶质的质量分数是24.5%;
(3)在将反应后剩余的固体置于坩埚中加热烘干过程中,有一部分铜与氧气反应生成氧化铜,导致质量增加;
故答案为:铜与氧气反应生成氧化铜.
点评:本题主要考查根据化学方程式的计算,注意格式要规范.

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
甲醛是室内装潢时,它的化学式为CH2O,下列说法正确的是( )
| A、甲醛的相对分子质量是32 |
| B、甲醛由碳原子和水分子组成 |
| C、甲醛由碳、氢、氧三种元素组成 |
| D、甲醛中碳、氢、氧三种元素的质量笔为1:2:1 |
 ”和“
”和“ ”分别表示两种不同的原子,如图所示是构成某些气体粒子的示意图,根据其组成特点回答(填序号)下列问题:
”分别表示两种不同的原子,如图所示是构成某些气体粒子的示意图,根据其组成特点回答(填序号)下列问题: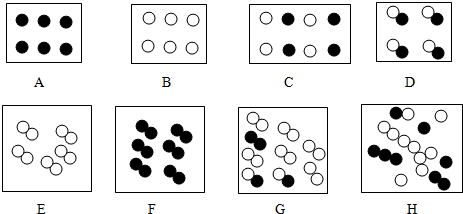
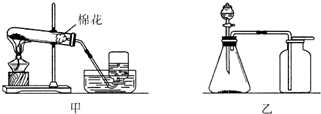 如图是实验室制取氧气的两种装置,请回答下列问题.
如图是实验室制取氧气的两种装置,请回答下列问题. 小明自制了一个“蜡烛抽水机”的实验装置,如图所示.他将一只塑料管完成∩形,一端插入硬制片,纸片与杯口密封(涂有凡士林),另一端插入右杯溶液中,点燃蜡烛,一段时间后蜡烛熄灭.这时左杯内气体压强将
小明自制了一个“蜡烛抽水机”的实验装置,如图所示.他将一只塑料管完成∩形,一端插入硬制片,纸片与杯口密封(涂有凡士林),另一端插入右杯溶液中,点燃蜡烛,一段时间后蜡烛熄灭.这时左杯内气体压强将