题目内容
现测得二氧化碳在空气中的含量为0.038%,当其含量超过0.05%时就会加剧温室效应.所以人们一方面想限制其排放量,另一方面又想对它进行再利用.(1)目前有以超临界(一种介于气态和液态之间的状态)CO2作致冷剂(以前曾用氟利昂),这种做法对环境的积极意义在于
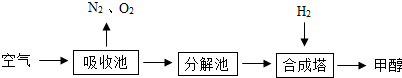
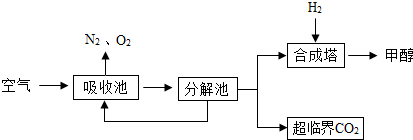
(2)有科学家提出回收利用CO2的构想:把空气吹入碳酸钾溶液,从溶液中提取出CO2,又在合成塔使之变为燃料甲醇(CH3OH).该技术流程如下:(提示:CO2+H2O+K2CO3=2KHCO3,2KHCO3=CO2+H20+K2CO3)

(说明:吸收池中盛有饱和的K2CO3溶液,合成塔内的反应条件为300℃、200kPa和催化剂.)
①合成塔中反应的化学方程式为
②请在上述流程图中找出循环利用的物质(标出物质名称和循环方向).
③如果空气不经过吸收池和分解池,而是直接通入合成塔,你认为可行吗?
④若生产4.8吨甲醇,则可回收空气中的CO2
分析:二氧化碳代替氟利昂是对臭氧层的保护.根据题中给出的条件可以得出化学方程式二氧化碳+氢气=甲醇(有催化剂).空气中的二氧化碳的含量是很低的,所以空气中的二氧化碳是无法直接利用的.根据化学方程式可以计算出所求的物质.
解答:解:91)氟利昂能破坏臭氧层,用二氧化碳代替氟利昂能保护臭氧层.故答:起到保护臭氧层的作用.
(2)①根据题中给出的条件,二氧化碳最后又被重新吸收,且在最后又加入氢气所以化学式是二氧化碳+氢气=甲醇(有催化剂).故选CO2+3H2
CH3OH+H2O.
②根据提示可以看出碳酸钾在被循环利用,且是在吸收池中反应在分解池中生成.故答: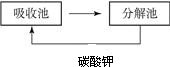
③空气中的二氧化碳含量太低通过吸收池和分解池是为了加大二氧化碳的浓度,之后再通入合成塔.故答;不行、如果直接通入合成塔,由于空气中CO2的含量太低了,不利于生成甲醇的反应进行.
④利用①的方程式去求解:
CO2+3H2
CH3OH+H2O
44 32
X 4.8t
=
X=6.6t
故答:6.6.
(2)①根据题中给出的条件,二氧化碳最后又被重新吸收,且在最后又加入氢气所以化学式是二氧化碳+氢气=甲醇(有催化剂).故选CO2+3H2
| ||
| 高温高压 |
②根据提示可以看出碳酸钾在被循环利用,且是在吸收池中反应在分解池中生成.故答:

③空气中的二氧化碳含量太低通过吸收池和分解池是为了加大二氧化碳的浓度,之后再通入合成塔.故答;不行、如果直接通入合成塔,由于空气中CO2的含量太低了,不利于生成甲醇的反应进行.
④利用①的方程式去求解:
CO2+3H2
| ||
| 高温高压 |
44 32
X 4.8t
| 44 |
| 32 |
| x |
| 4.8g |
X=6.6t
故答:6.6.
点评:此题通过研究二氧化碳对环境的影响考察对二氧化碳的了解.根据题中的条件对化学方程式的推理,根据化学方程式进行数据的求解都是考察的重点.

练习册系列答案
 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案
相关题目