题目内容
【题目】为了测定某石灰石样品中碳酸钙的含量,取20g此样品,将80g的稀盐酸分四次加入样品使之充分反应(石灰石中的杂质不溶于水,也不与盐酸及生成物反应),每次用盐酸的质量与反应后剩余固体的质量见下表.(计算结果保留到小数点后一位数字)
次 数 | 一 | 二 | 三 | 四 |
加入盐酸的质量/g | 20 | 20 | 20 | 20 |
剩余固体的质量/g | 15 | 10 | 5 | 5 |
计算:(1)样品中碳酸钙的质量分数____;
(2)20g此样品与足量盐酸反应最多生成二氧化碳的质量____;
(3)加入的稀盐酸中溶质的质量分数____.
【答案】75% 6.6g 18.25%
【解析】
(1)比较第一、二、三次的数据可知:20g盐酸完全反应可以消耗碳酸钙15g﹣10g=5g;第四次中固体不再减少,说明此时碳酸钙已完全反应,样品中含有5g杂质,所以碳酸钙质量为15g,所以碳酸钙质量分数为:![]() ×100%=75%;
×100%=75%;
(2)设15g的碳酸钙生成二氧化碳为x,
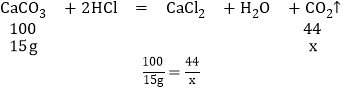
X=6.6g
(3)第一次加入20g盐酸消耗的碳酸钙的质量是5g,设与5克碳酸钙反应的HCl的质量为y,
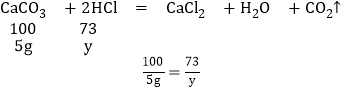
y=3.65g
所以盐酸的质量分数为:![]() ×100%=18.25%.
×100%=18.25%.
答:样品中碳酸钙的质量分数为75%,最多生成二氧化碳的质量6.6g,加入的稀盐酸中溶质的质量分数为18.25%.

练习册系列答案
相关题目