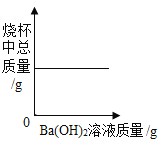
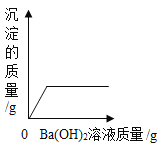
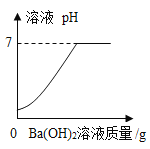
题目内容
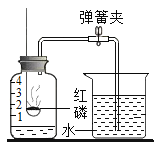
【题目】已知某固体混合物A中可能含有BaCl2、Na2SO4、NH4NO3、KNO3、CuO五种物质中的两种或多种。按下图所示进行实验,出现的现象如图所述(设过程中所有发生的反应都恰好完全进行),试根据实验过程和发生的现象做出判断,并填写以下空白:
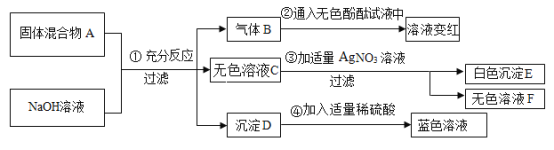
(1)在常温下,气体B的水溶液pH_______7(填“大于”小于”等于”之一);
(2)沉淀E的化学式为___________;
(3)固体混合物A里,一定不存在的物质是______(写化学式),得此结论的理由是:____。
(4)固体混合物A中,肯定存在的物质是________(写化学式)。
(5)溶液F中肯定存在的金属阳离子为_________(写离子符号).
(6)实验过程④中发生反应的化学方程式为__________。
【答案】大于 AgCl Na2SO4 混合物中含有氯化钡,如果含有硫酸钠,硫酸钠会与氯化钡反应生成硫酸钡沉淀 NH4NO3、BaCl2、CuO Na+、Ba2+ CuO+H2SO4═CuSO4+H2O
【解析】
(1)硝酸铵和氢氧化钠溶液反应生成硝酸钠、氨气和水,说明混合物中含有硝酸铵,无色气体B为氨气,氨气溶于水生成氨水,氨水显碱性,pH大于7;故填:大于;
(2)氯化钡与硝酸银反应生成氯化银沉淀,证明混合物中含有氯化钡;故填:AgCl;
(3)固体混合物A里,一定不存在的物质是硫酸钠,由(2)可知,混合物中含有氯化钡,如果含有硫酸钠,硫酸钠会与氯化钡反应生成硫酸钡沉淀,硫酸钡沉淀不溶于酸,步骤④中就会有固体剩余,故一定不含硫酸钠。故填:Na2SO4;混合物中含有氯化钡,如果含有硫酸钠,硫酸钠会与氯化钡反应生成硫酸钡沉淀;
(4)步骤④加稀硫酸溶液变成蓝色,证明含有氧化铜,又由(1)(2)可知,固体混合物A中,肯定存在的物质是硝酸铵、氯化钡和氧化铜;故填:NH4NO3、BaCl2、CuO;
(5)步骤①硝酸铵和氢氧化钠溶液反应生成硝酸钠、氨气和水,步骤③氯化钡与硝酸银反应生成氯化银沉淀和硝酸钡,溶液F中肯定存在的金属阳离子为钠离子和钡离子;故填:Na+、Ba2+。
(6)实验过程④是氧化铜稀硫酸反应生成硫酸铜和水,反应的化学方程式为:CuO+H2SO4═CuSO4+H2O;故填:CuO+H2SO4═CuSO4+H2O。

【题目】化学小组用排水法收集了呼出气体,通过(实验1)比较吸入空气和呼出气体的成分差异。
(实验1)
序号 | 实验目的 | 实验操作 | 实验现象 |
① | 比较空气和呼出气体中二氧化碳的含量 | 向呼出气体中倒入少量澄清石灰水,振荡 | _____ |
② | 比较空气和呼出气体中氧气的含量 | 分别将燃着的木条伸入空气和呼出气体中 | 空气中的木条无明显变化,呼出气体中的木条熄灭 |
③ | _____ | 取两块干燥玻璃片,对着其中一块哈气 | 哈气的玻璃片上出现无色液滴,另一块无明显变化 |
(1)实验①的现象为_____,证明呼吸过程中发生了_____(“物理”或“化学”)变化。
(2)实验③的目的是_____。
(3)小明指出实验①不能比较空气和呼出气体中CO2的含量,还需补充的实验操作为_____。小芳对②中燃着木条熄灭的原因提出猜想,并设计(实验2)进行验证。
(猜想与假设)
猜想1:木条熄灭是因为呼出气体比吸入空气中CO2的含量高。
猜想2:木条熄灭是因为呼出气体比吸入空气中O2的含量低。
(实验2)
序号 | ① | ② | ③ | ④ |
实验操作 |
空气 |
O2和CO2体积比 |
O2和N2体积比 |
O2和N2体积比 |
实验现象 | 燃着的木条无明显变化 | 燃着的木条无明显变化 | 燃着的木条熄灭 | 燃着的木条熄灭 |
(4)由实验①和②可得出猜想1_____(填“成立”或“不成立”)。
(5)(实验2)中,能证明猜想2成立的实验序号是_____。
(实验反思)
(6)根据以上实验,下列说法正确的是_____(填字母序号)。
A 吸入空气和呼出气体中O2和CO2的含量不同
B 将燃着木条伸入呼出气体中,木条熄灭,说明呼出气体中没有O2
C (实验1)的②中,燃着木条熄灭的原因还可能与水蒸气含量增多有关
D 若把燃着木条伸入体积比为1:1的O2和CO2混合气体中,会观察到无明显变化