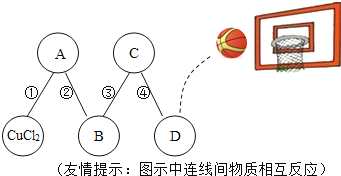
题目内容
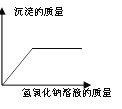
【题目】Na2CO3中往往会含有少量的NaCl,现在一烧杯中盛有20.4g的该固体混合物,向其中逐渐滴加溶质质分数为10%的稀盐酸。放出气体的质量与所滴入稀盐酸的质量关系曲线如下图所示:求
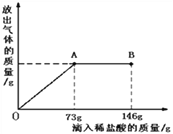
⑴恰好反应时,消耗盐酸中的溶质质量。
⑵此时,所得溶液(所得溶液为不饱和溶液)中溶质的质量分数(计算结果精确到0.1%)。
【答案】⑴7.3g ⑵ 24.2%
【解析】由图中信息知,⑴恰好反应时,消耗盐酸中的溶质质量∶73g×10%=7.3g。
⑵解∶反应后生成氯化钠质量为x,生成二氧化碳质量为y,参加反应的碳酸钠质量为z
2HCl+Na2CO3 =2NaCl+CO2↑+H2O
73 106 117 44
73g×10% z x y
![]() =
=![]() ,x=11.7g。
,x=11.7g。
![]() =
=![]() ,y=4.4g。
,y=4.4g。
![]() =
=![]() ,z=10.6g。
,z=10.6g。
根据质量守恒定律所得溶液质量为20.4g+73g-4.4g=89g;
由题中信息和计算所得有关数据,所得溶液溶质质量为20.4g-10.6g+11.7g=21.5g。
所得溶液(所得溶液为不饱和溶液)中溶质的质量分数∶![]() ×100%=24.2%。
×100%=24.2%。
答∶所得溶液(所得溶液为不饱和溶液)中溶质的质量分数是24.2%。
点睛∶灵活应用质量守恒定律,正确书写化学化学方程式并根据化学方程式进行计算,是顺利完成本题的重要保证。

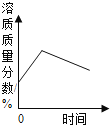
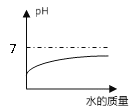
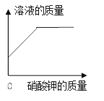
【题目】下列四个图像中,不能正确表示对应变化关系的是 ( )
|
|
|
|
A.向一定量稀硫酸中加水稀释 | B.一定温度下,向不饱和硝酸钾溶液中加入硝酸钾 | C.加热一定质量的 高锰酸钾固体 | D.向一定质量的硫酸铜和稀硫酸的混合溶液中逐滴加入氢氧化钠溶液 |
A. A B. B C. C D. D
【题目】如图是一套检验气体性质的实验装置,向装置中持续通入气体X,若打开活塞K,只观察到紫色石蕊变红;若关闭活塞K,可观察到紫色石蕊试液变红,澄清石灰水变浑浊。据此判断气体X和洗瓶内的液体Y可能是( )
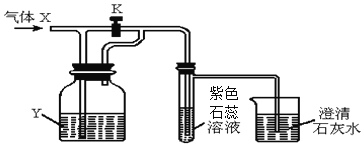
A | B | C | D | |
X | 二氧化碳 | 氯化氢 | 二氧化碳 | 氯化氢 |
Y(足量) | 水 | 碳酸钠溶液 | 氢氧化钠溶液 | 氢氧化钠溶液 |
A. A B. B C. C D. D