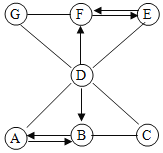
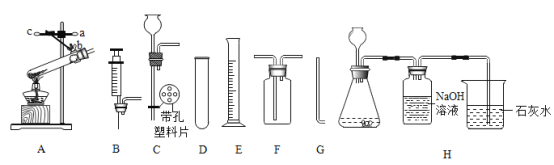
题目内容
【题目】下列化学方程式符合题意且书写正确的是
A.除去氯化钠中少量的碳酸钠:Na2CO3+2HNO3=2NaNO3+H2O+CO2↑
B.用盐酸除铁锈:FeO+2HCl=FeCl2+H2O
C.铁在氧气中燃烧:3Fe+2O2![]() Fe2O3
Fe2O3
D.医疗上用氢氧化镁中和过多胃酸:Mg(OH)2+2HCl=MgCl2+2H2O
【答案】D
【解析】
A、根据化学方程式可知,除去碳酸钠后,又引入了硝酸钠,故A错。
B、铁锈的主要成分是氧化铁,化学方程式为Fe2O3+6HCl=2FeCl3+3H2O,故B错。
C、铁在氧气中燃烧生成四氧化三铁,化学方程式为3Fe+2O2![]() Fe3O4,故C错。
Fe3O4,故C错。
D、医疗上用氢氧化镁中和过多胃酸化学方程式为;Mg(OH)2+2HCl=MgCl2+2H2O,故D正确。
故选:D。

 名校课堂系列答案
名校课堂系列答案【题目】小明在科教频道节目中了解到水冲压发动机是一种新型动力装置,其主要原理是应用金属镁与热水能发生化学反应。那么镁与水反应的快慢与哪些因素有关呢?小明和同学们一起对此展开了探究。
(查阅资料)
①氯化铵能与氢氧化镁反应产生氨气、水、氯化镁2NH4Cl+Mg(OH)2═MgCl2+2NH3↑+2H2O
②浓硫酸能吸收氨气,且不产生其他气体。
(提出问题)镁与水反应的快慢与哪些因素有关呢?
(建立猜想)①镁与水反应的快慢可能与反应物的温度有关。
②_____________
(实验探究)小明验证猜想①按照甲图装置进行实验(恒温器内可保持温度恒定)
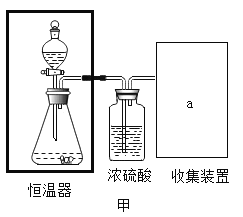
在甲图的锥形瓶和分液漏斗中,分别加入等量的镁条和蒸馏水,改变反应物温度,并记录如下表:
反应物温度(℃) | 50 | 55 | 60 | 65 | 70 |
收集50mL氢气所用时间(秒) | 295 | 257 | 196 | 124 | 74 |
(反思与总结)
(1)本实验是通过观察_____________来判断镁与水反应的快慢。
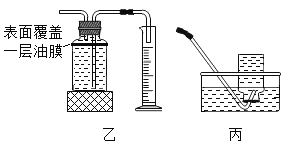
(2)乙、丙两图均属于收集装置,本实验a处收集装置应选用____________。(选填乙或丙)表面覆盖一层油膜的目的______________;金属镁能与热水反应生成氢氧化镁和氢气化学方程式___________。
(3)一段时间后,小明观察到镁条(镁条和热水均有剩余)表面无气泡产生,即反应停止了。但加入少量氯化铵溶液后,镁条表面又冒出气泡,且收集装置中的气体体积继续增加。解释“镁与热水反应一段时间后会停止,但加入氯化铵溶液后,镁与水的反应会继续进行”现象的原因是___________。