题目内容
质量守恒定律的定量研究对化学发展具有重大意义.
(1)已知m1g镁条放在空气中完全燃烧,生成m2g氧化镁(不考虑其它反应),m1______m2.小明在做该实验时,观察到耀眼的白光,冒出大量白烟,称量无误时,发现m1>m2,其原因是______.
(2)纳米材料和纳米技术的应用涉及现代工业的各个领域.用纳米级的某种氧化物做催化剂,可以使汽车尾气中的CO和NO迅速反应转化为两种气体,其中一种是空气中含量最多的气体.请你写出该反应的化学方程式______.
解:(1)根据质量守恒定律,生成氧化镁的质量=参加反应的镁的质量+氧气的质量,所以m1小于m2;镁带燃烧时放出耀眼的白光,放出大量的热,放出大量的白烟,仔细观察会发现:白烟有很大一部分向上,生成物氧化镁部分以白烟的形式逸散(或扩散)到空气中导致m1>m2.
(2)依据其中一种是空气中含量最多的气体确定一种物质是氮气,依据化学反应前后元素的种类不变确定一种生成物是二氧化碳,从而得到化学方程式是:2CO+2NO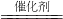 N2+2CO2
N2+2CO2
故答案为:(1)<;生成物氧化镁部分以白烟的形式逸散(或扩散)到空气中(2)2CO+2NO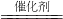 N2+2CO2
N2+2CO2
分析:(1)依据质量守恒定律的内容分析产物的质量大于镁条的质量,依据反应时氧化镁以白烟的形式扩散到空气中分析m1>m2的原因;
(2)依据质量守恒定律推论反应前后元素的种类不变确定其中一种生成物,依据其中一种是空气中含量最多的气体确定另外一种生成物,从而书写出有关的方程式.
点评:此题主要考查学生对质量守恒定律的实际运用,只有掌握了这一知识的内涵,才能自由驾御.
(2)依据其中一种是空气中含量最多的气体确定一种物质是氮气,依据化学反应前后元素的种类不变确定一种生成物是二氧化碳,从而得到化学方程式是:2CO+2NO
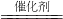 N2+2CO2
N2+2CO2故答案为:(1)<;生成物氧化镁部分以白烟的形式逸散(或扩散)到空气中(2)2CO+2NO
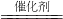 N2+2CO2
N2+2CO2分析:(1)依据质量守恒定律的内容分析产物的质量大于镁条的质量,依据反应时氧化镁以白烟的形式扩散到空气中分析m1>m2的原因;
(2)依据质量守恒定律推论反应前后元素的种类不变确定其中一种生成物,依据其中一种是空气中含量最多的气体确定另外一种生成物,从而书写出有关的方程式.
点评:此题主要考查学生对质量守恒定律的实际运用,只有掌握了这一知识的内涵,才能自由驾御.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
 ”和“
”和“ ”分别表示两种不同的原子:
”分别表示两种不同的原子: 由“
由“ ”聚集成的物质
”聚集成的物质 质量守恒定律的定量研究对化学科学发展具有重大意义.
质量守恒定律的定量研究对化学科学发展具有重大意义. ”和“
”和“ ”分别表示两种不同的原子:
”分别表示两种不同的原子: ”聚集成的物质
”聚集成的物质 ”和“
”和“ ”分别表示两种不同的原子:
”分别表示两种不同的原子:
 ”聚集成的物质
”聚集成的物质