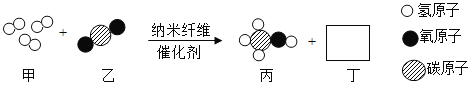
题目内容
【题目】某白色粉末可能由CuSO4,NaOH,BaCl2,CaCO3,Na2SO4中的两种或两种以上物质组成,有关实验及现象如下图所示:
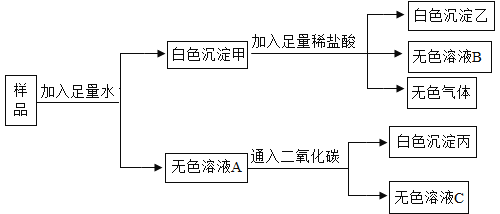
(1)将白色沉淀甲和无色溶液A分离开的实验操作名称是___________;
(2)白色沉淀甲与稀盐酸混合产生气体的化学方程式是___________;
(3)综合分析上述实验,可以确定原白色粉末的成分是_____________;
(4)无色溶液A中的溶质是_____________。
【答案】过滤 ![]() NaOH,BaCl2,CaCO3,Na2SO4 NaCl,BaCl2,NaOH
NaOH,BaCl2,CaCO3,Na2SO4 NaCl,BaCl2,NaOH
【解析】
硫酸铜在溶液中显蓝色,碳酸钙难溶于水,硫酸钠和氯化钡反应生成不溶于酸的硫酸钡沉淀,二氧化碳和氢氧化钠反应生成碳酸钠,碳酸钠和氯化钡会生成碳酸钡沉淀。
样品加水溶解,得到白色沉淀甲和无色溶液A,所以样品中一定不含硫酸铜,白色沉淀甲加入稀盐酸,部分溶解,生成了无色气体,所以样品中一定含有氯化钡、硫酸钠、碳酸钙,可能含有氢氧化钠,无色溶液A中通入二氧化碳,生成白色沉淀丙,所以样品中一定含有氯化钡、氢氧化钠。
(1)将白色沉淀甲和无色溶液A分离开的实验操作名称是过滤;
(2)白色沉淀甲与稀盐酸混合产生气体的反应是碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,化学方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)综合分析上述实验,可以确定原白色粉末的成分是:NaOH、BaCl2、CaCO3、Na2SO4;
(4)氯化钡与硫酸钠反应生成硫酸钡沉淀和氯化钠,无色溶液A中一定含有氯化钠;无色溶液A中通入二氧化碳,生成白色沉淀,说明溶液A中还有氢氧化钠和过量的氯化钡,氢氧化钠与二氧化碳反应生成碳酸钠和水,碳酸钠与氯化钡反应生成碳酸钡沉淀和氯化钠;综上,无色溶液A中的溶质是NaOH、BaCl2、NaCl。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案【题目】某兴趣小组在制取氧气的实验过程中,有如下实验设计方案,该方案的实验目的是:探究_______对反应速率的影响。
编号 | 温度 | 催化剂 | 氯酸钾、二氧化锰的质量比 | 生成1升氧气所需时间/s |
实验Ⅰ | 400℃ | MnO2 | 1:1 | 153 |
实验Ⅱ | 400℃ | MnO2 | 2:1 | 240 |
小芳在实验时,误把氧化铁当作二氧化锰放入加热,结果发现也能较快产生氧气,于是进行如下探究:
(猜想Ⅰ)除二氧化锰、氧化铜外,氧化铁(Fe2O3)也可以作氯酸钾分解的催化剂。
(设计实验)
按下表进行实验,并测定开始产生气体时的温度(提示:开始产生气体的温度越低,表示反应速度越快)。
实验编号 | 实验药品 | 分解温度(℃) |
① | 氯酸钾 | 580 |
② | 氯酸钾和二氧化锰(质量比1︰1) | 350 |
③ | 氯酸钾和氧化铜(质量比1︰1) | 370 |
④ | 氯酸钾和氧化铁(质量比1︰1) | 390 |
(数据和结论)
(1)由实验_________与实验④对比,证明猜想合理;
(2)实验所用的三种物质中,催化效果最好的是__________。
(反思)
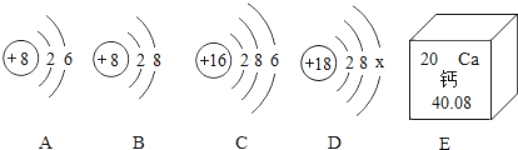
(1)若要证明氧化铁是该反应的催化剂,还需验证它在化学反应前后的______和______是否改变。小林在实验时,联想到了渔民用过氧化钙(CaO2)增加鱼池中的含氧量,提出猜想Ⅱ。
(猜想Ⅱ)过氧化钙与水反应可制取氧气。
实验装置 | 实验主要过程 |
| ①检查装置气密性。 ②加入过氧化钙和水后,有少量细小气泡缓慢放出,在导管口几乎收集不到气体。该装置放置到第二天,集气瓶中只收集到极少量气体,震荡试管后仍有少量细小气泡缓慢放出。 |
实验结论:过氧化钙与水反应________(填“能”或“不能”)用于实验室制取氧气。
(分析与反思)
(1)过氧化钙与水反应虽然没有快速收集到大量氧气,但由此实验现象,小林认为渔民用过氧化钙做增氧剂的主要原因是__________。
(2)小林希望对此实验进行改进,使该反应加快,请你帮他提出合理化建议_________。
(3)同学们对过氧化钙与水反应的生成物猜想如下:①氢氧化钙和氧气②碳酸钙和氧气。你认为猜想_________ (填序号)一定是错误的,理由是_________。