题目内容
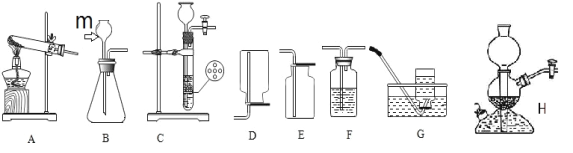
【题目】某固体粉末由Mg、MgO、Mg(OH)2中的一种或几种组成。某科学小组为了探究该固体粉末的成分,设计如图所示的装置(固定装置省略)。
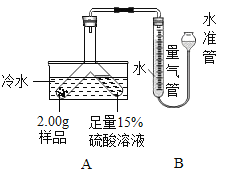
(信息资料)本实验条件下,氢气密度为0.09g/L。
(实验过程)
步骤Ⅰ:检查装置气密性,装入药品并连接仪器。
步骤Ⅱ:倾斜Y形管,使样品充分反应,测的生成气体的体积为556mL。
步骤Ⅲ:拆下装置,往Y形管内残余液中加入氢氧化钠溶液,至不再生成沉淀。经过滤、洗涤和干燥后,称得沉淀质量为2.90g。
(回答问题)
(1)用冷水浴的原因是_____。
(2)为使样品完全反应的正确操作是_____(填标号)。
A硫酸溶液转移到样品中 B样品转移到硫酸溶液中
(3)根据实验结果通过步骤Ⅲ计算,样品中镁元素的总质量为_____。
(反思)
(4)该化学小组同学经过讨论得出以下结论,正确的是_____(填标号)。
A利用该实验方案,能计算出样品中各物质的质量
B实验前可通过样品的质量估算硫酸溶液的质量,确保样品完全反应
【答案】防止产生的气体由于反应放热而膨胀 A 1.20g AB
【解析】
(1)用冷水浴的原因是:防止产生的气体由于反应放热而膨胀,从而防止计算结果不准确;
(2)为了防止固体药品粘在容器壁上,可将液态的硫酸溶液转移到样品中;
(3)步骤Ⅲ中有沉淀生成的方程式为MgSO4+2NaOH=Na2SO4+Mg(OH)2↓,所以氢氧化镁的质量为2.90g;
样品中镁元素的总质量为:2.90g×![]() ;
;
(4)A、设镁质量为x,计算过程如下:
反应生成氢气质量为:0.09g/L×0.0556L=0.005g,
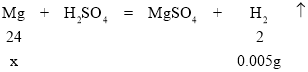 ,
,
![]() ,解得x=0.06g;
,解得x=0.06g;
则另外物质质量为:2.00g﹣0.06g=1.94g,另外物质镁元素质量为:1.2g﹣0.06g=1.14g,
假设另外物质是氧化镁,则1.94g氧化镁中镁元素质量为:
1.94g×![]() ;
;
假设另外物质是氢氧化镁,则1.94g氢氧化镁中镁元素质量为:1.94g×![]() =0.80g<1.14g,
=0.80g<1.14g,
因此样品中含有镁、氧化镁和氢氧化镁,知道镁、氧化镁和氢氧化镁的质量、沉淀氢氧化镁的质量,可以计算出氧化镁和氢氧化镁的质量,该选项说法正确;
B、实验前可通过样品的质量估算硫酸溶液的质量,确保样品完全反应,该选项说法正确;故选:AB。

 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案【题目】下列物质在密闭容器内的一定条件下充分反应,反应前后各物质的质量如下表所示。
物质 | X | O2 | CO2 | H2O |
反应前的质量(g) | 23 | 80 | 2 | 2 |
反应后的质量(g) | 待测 | 32 | 46 | 29 |
下列说法中正确的是()
A.反应后H2O的质量为27g
B.生成的CO2含氧元素44g .
C.物质X含有氧元素
D.该反应是分解反应