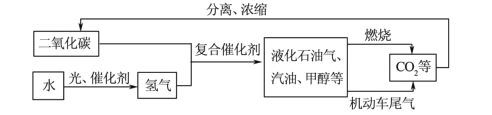
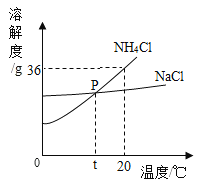
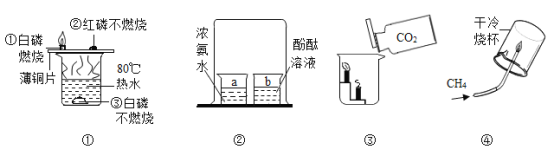
题目内容
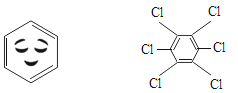
【题目】图1为溴原子(Br)的结构示意图:图2为A、B、C、D、E五种粒子的结构示意图。
请回答下列问题:
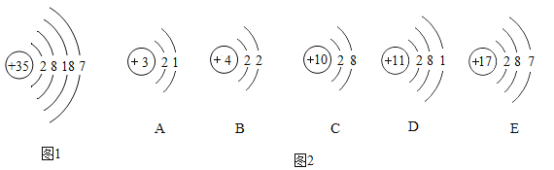
(1)图1粒子第三层电子数与最外层电子数之差为_____ ;图2中与图1粒子化学性质相似的是____ (填字母代号)。
(2)图2中E粒子形成的单质的化学式是_______________。
(3)图2的结构示意图中,________________(填字 母代号)表示的是非金属元素的粒子。
(4)图2中C粒子构成的单质所属的这类气体统称为________________。
(5)含有图2中D元素的氧化物的化学式是________________,标出其中非氧元素的化合价________________。
【答案】11 E Cl2 E 稀有气体 Na2O ![]()
【解析】
(1)图一的微粒中,第三个电子层的电子书为18,最外层电子数为7,两个电子层相差11个电子。若最外层电子数相同,则两种元素的化学性质相似,则A~E中,E和图1的元素的化学性质相似。故答案为:11、E;
(2)图2中,E的核电荷数是17。在原子中,核电荷数=核外电子数=质子数,则E是第17号元素,氯元素。由氯元素形成的单质是氯气。一个氯气分子中有两个氯原子。故答案为:Cl2;
(3)图2中,根据“核电荷数=质子数”可知,A是锂元素、B是铍元素、C是氖元素、D是钠元素、E是氯元素。其中E是非金属元素,A~D是金属元素。故答案为:E;
(4)图2中,C是氖元素。氖元素属于稀有气体元素,构成的单质是稀有气体。故答案为:稀有气体;
(5)图2中,D是钠元素,在形成化合物时,易失去一个电子形成钠离子,显+1价。而氧化物中,氧元素显-2价。钠元素和氧元素化合形成的化合物为Na2O。故答案为:Na2O、![]() 。
。

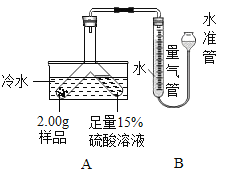
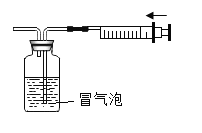
【题目】为探究碳还原氧化铜的最佳实验条件,取木炭粉和氧化铜的干燥混合物1-2.5g用如图所示装置进行实验。
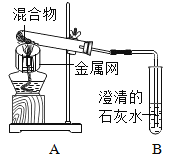
(1)木炭还原氧化铜的化学方程式为__。实验过程中A装置中试管内产生的现象是__。
(2)酒精灯火焰加金属网罩的目的是____。
(查阅资料)①氧化铜(CuO)为黑色固体。②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,能与稀硫酸反应:Cu2O+H2SO4=CuSO4+H2O+Cu
(进行试验)取一定量的混合物,用上图所示装置进行实验。
序号 | 木炭粉与氧化铜的质量比 | 反应后物质的颜色、状态 | |
1 | 1:9 | 红色固体有金属光泽 | 混有少量黑色物质 |
2 | 1:10 | 混有很少量黑色物质 | |
3 | 1:11 | 混有极少量黑色物质 | |
4 | 1:12 | 无黑色物质 | |
5 | 1:13 | 混有较多黑色物质 | |
(结论与解释)(3)由上述实验可以得到的结论是___,条件最佳。
(反思与评价)
(4)为了检验生成的红色固体中是否含有Cu2O,所需试剂是____。
(5)该装置与教材中的装置相比略作改进,实验结束时,可先用弹簧夹夹紧橡皮管,再熄灭酒精灯,这样做的目的除了防止石灰水倒吸入热的试管,使试管炸裂外,还可以防止____。