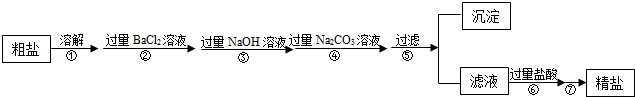
题目内容
将氢氧化钠和氯化钠的混合物19.3g,放入80.7g水中使其完全溶解,再加入100g溶质质量分数为7.3%的稀盐酸,恰好完全反应.试计算:
(1)l00g 7.3%的稀盐酸中溶质的质量.
(2)原混合物中氢氧化钠的质量.
(3)反应后所得溶液中溶质的质量分数.
(1)l00g 7.3%的稀盐酸中溶质的质量.
(2)原混合物中氢氧化钠的质量.
(3)反应后所得溶液中溶质的质量分数.
(1)7.3g (2)8g (3)11.5%
试题分析:(l)稀盐酸中溶质的质量为:l00g×7.3%=7.3g;
(2)设氢氧化钠的质量为x,生成氯化钠的质量为y.
NaOH+HCl=NaCl+H2O
40 36.5 58.5
X 7.3g y
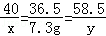
解得:x=8g y=11.7g
(3)所得溶液中溶质的质量分数为:
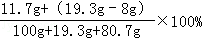 =11.5%
=11.5%答:(1)l00g 7.3%的稀盐酸中溶质的质量是7.3g;
(2)原混合物中氢氧化钠的质量是8g;
(3)反应后所得溶液中溶质的质量分数是11.5%.
点评:本题考查学生利用酸碱发生的化学反应方程式来进行的有关计算,学生应明确反应后的溶液中的溶液中溶质的来自两部分,利用质量守恒定律会计算溶液的总质量是解答此类习题的关键.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目