题目内容
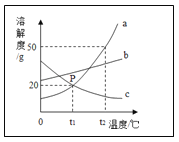
【题目】小敏对实验室用石灰石和稀盐酸制取二氧化碳后的废液,进行溶质成分鉴定.取废液上层清液50克,逐滴加入质量分数为26.5%的碳酸钠溶液,出现气泡,滴加至10克开始出现白色沉淀.继续滴加至沉淀不再产生,过滤,测得沉淀的质量为5克,并绘制了图象.

(1)滴加的溶液中溶质属于_____(填“盐”或“碱”).
(2)10克碳酸钠溶液中含有的溶质质量是______克.
(3)图中a点的数值是____________.
(4)废液中含有的溶质是________(写化学式).
(5)通过计算说明,图象横坐标中的b点表示的溶液的质量是多少克?(书写过程)________
【答案】 盐 2.65 1.1 HCl CaCl2 30g
【解析】试题分析:1)滴加的碳酸钠属于盐类。
2)10g碳酸钠溶液中含溶质的质量为:10g╳26.5%=2.65g
3)图中a点表示生成气体的最大值。可利用二氧化碳与碳酸钠在反应中的质量关系进行求解。解题过程为:
解:设生成二氧化碳气体的质量为x
2HCl+Na2CO3= 2NaCl+H2O+CO2↑
106 44
2.65g x
106:44=2.65g:x
x=1.1g
所以a点的数值为1.1
4)反应生成的气体是碳酸钠与原来过量的稀盐酸反应生成的二氧化碳。当不再生成气体时,再加入碳酸钠生成白色沉淀,是因为原溶液中的氯化钙与碳酸钠反应的原因。所以可说明原溶液中含有稀盐酸(HCl)和氯化钙(CaCl2)。
5)b点是生成沉淀的质量为5g时,所加入的碳酸钠溶液的质量。其质量为和稀盐酸反应的碳酸钠溶液(10g)与和氯化钙反应的碳酸钠溶液的质量的和。
未知:和氯化钙反应的碳酸钠溶液的质量 已知:碳酸钙沉淀的质量为5g。
解题思路:可利用二者在化学方程式中的质量关系进行求解。
解:设与氯化钙反应的碳酸钠溶液中溶质质量为x,
CaCl2+Na2C03= 2NaCl+CaC03↓
106 100
x 5g
![]()
x=5.3g
溶液质量是5.3g÷26.5%=20g
b点质量应标20g+10g=30g
答:b点表示的溶液的质量是30g

 夺冠金卷全能练考系列答案
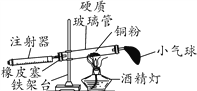
夺冠金卷全能练考系列答案【题目】下图是木炭还原氧化铜的探究实验装置。
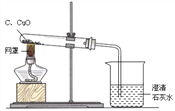
【提出问题】木炭还原氧化铜产生什么气体?
【提出猜想】产生的气体有三种情况:⑴CO,⑵CO2, ⑶ ______________。
【设计方案】实验前后分别对试管和烧杯里的物质进行称量,数据设计如下:
称量对象 | 反应前质量 | 反应后质量 | 质量差 |
试管+固体混合物 | M1 | M2 | △m1即( M1-M2) |
烧杯+澄清石灰水 | M3 | M4 | △m2即( M4-M3) |
(1)若△m2=0,说明反应产生的气体不能被澄清石灰水吸收,则猜想__________成立。
(2)若猜想②正确,理论上△m1与△m2 的关系是:△m1______△m2(填“>”、“<”或“=”)。
【实验并记录】实验得到的数据如下表:
称量对象 | 反应前质量 | 反应后质量 | 质量差 |
试管+固体混合物 | 69.8g | 65.4g | △m1 |
烧杯+澄清石灰水 | 118.8g | 122.6g | △m2 |
用以上实验数据分析,结果应该是猜想________成立。
【反思与评价】经查阅资料知道:木炭还原氧化铜产生CO2气体,该反应的化学方程式为:_____。本次实验结果与资料显示不一致。对其可能原因有同学提出下列分析,其中合理的是__________。
A.装置漏气 B.生成的CO2部分与过量的C反应生成了CO
C.澄清石灰水吸收CO2效果不好 D.装置内还有CO2气体未被吸收