题目内容
【题目】某实验小组利用废硫酸溶液制备K2SO4的流程如下:
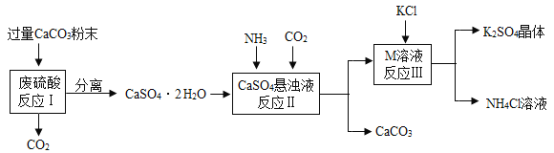
(1)将CaCO3研成粉末的目的是___________________。
(2)上述流程中可循环使用的物质有CO2和__________________(填写化学式);
(3)洗涤反应Ⅲ所得晶体不用水而用饱和K2SO4溶液的目是___________________。
(4)检验反应Ⅲ所得晶体是否洗干净的方法是:取最后次洗涤液, 先加入过量的Ba(NO3)2溶液,振荡、过滤,再向滤液中滴加_______________, 如果没有白色沉淀,说明洗涤干净。
【答案】使废液中的硫酸完全反应 ![]() 减少
减少![]() 的溶解
的溶解 ![]() 溶液
溶液
【解析】
碳酸钙与硫酸反应生成硫酸钙、水和二氧化碳。
(1)碳酸钙与硫酸反应生成硫酸钙、水和二氧化碳,加入过量CaCO3粉末的目的是使废液中的硫酸完全反应。
(2) 上述流程中碳酸钙开始是反应物后来是生成物,而二氧化碳开始是生成物,后来是反应物,所以可循环使用的物质的化学式为![]() 和
和![]() 。
。
(3) 由于硫酸钾易溶于水而不溶于其饱和溶液,所以洗涤反应Ⅲ所得晶体不用水而用饱和![]() 溶液的目是减少
溶液的目是减少![]() 的溶解。
的溶解。
(4) 检验反应Ⅲ所得晶体是否洗涤干净,由于是检验硫酸钾表面是否含有氯化铵,由于给出的思路是转化为沉淀,即在硫酸根离子存在的情况下检验氯离子,所以需要先沉淀掉硫酸根离子然后检验氯离子,具体的方法是:取最后一次洗涤液,先加入过量的Ba(NO3)2溶液,振荡、过滤,再向滤液中滴加![]() 溶液,如果没有白色沉淀,说明洗涤干净。
溶液,如果没有白色沉淀,说明洗涤干净。

【题目】探究纯碱成分。我国科学家侯德榜在氨碱法的基础上创立了候氏制碱法,其生产流程简明如下图:
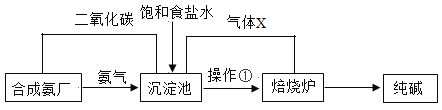
请根据流程图回答下面问题:
(1)写出沉淀池中发生反应的化学方程式___________。
(2)上述流程中气体X的化学式是___________
(3)沉淀池中晶体转移至熔烧炉时用到操作①,操作①的名称是____________。
(4)用“侯氏制碱法”制得的纯碱中可能含有碳酸氢钠、氯化钠等杂质,化学兴趣小组对某品牌纯碱样品的成分及含量进行了实验探究
(定性实验)探究样品的成分
实验步骤 | 实验现象 | 实验结论. |
_______ | _______ | 样品中不含碳酸氢钠 |
_______ | _______ | 样品中含有氯化钠 |
(定量实验)利用样品与稀盐酸反应,测定Na2CO3的质量分数。实验装置(铁架台略去)如下图所示。(装置气密性良好,忽略盐酸的挥发性且每步反应成作用都是完全的)。
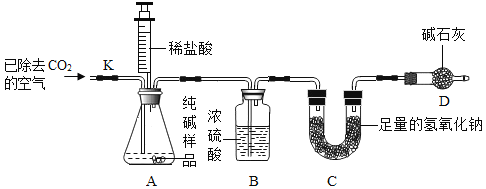
实验步骤:
1检查装置的气密性,将6g纯碱样品放入锥形瓶中
2称量反应前C装置质量为50g
3组装装置,用注射器向A中加入50mL稀盐酸时,A中不再产生气泡。
4打开止水夹K,通入已除去CO2的空气,一段时间后关闭止水夹
5称量装置C反应后的质量为52.2g
(5)①评价方案:步骤4的作用是______________,缺少装置B,将会使测定结果____________(选填“偏大”成“偏小“或“不变”).
②根据题中的数据计算纯碱样品中碳酸钠的质量分数为____________(计算结果精确到0.1%)。
【题目】长久使用热水壶底部有层水垢,主要成分为CaCO3和Mg(OH)2,某学校化学研究小组的同学通过实验测定水垢中CaCO3的含量:将过量的稀盐酸加入到200g水垢中,把产生的CO2气体用足量的NaOH溶液吸收,同时测量3min钟内NaOH溶液增加的质量,结果如下表:
时间/s | 0 | 30 | 60 | 90 | 120 | 150 | 180 |
质量/g | 0 | 30 | 50 | 60 | 66 | 66 | 66 |
(1)写出CO2被足量的NaOH溶液吸收时,发生的化学反应方程式_______________。
(2)从表格中可以看出,200g水垢与盐酸反应生成的CO2最多是___________g。
(3)计算水垢中碳酸钙的质量分数,写出计算过程_________