��Ŀ����
����Ŀ��̽������ɷ֡��ҹ���ѧ�Һ�°��ڰ���Ļ����ϴ����˺����Ƽ�����������̼�������ͼ��
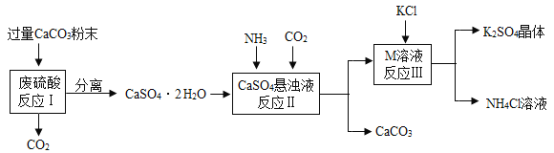
���������ͼ�ش��������⣺
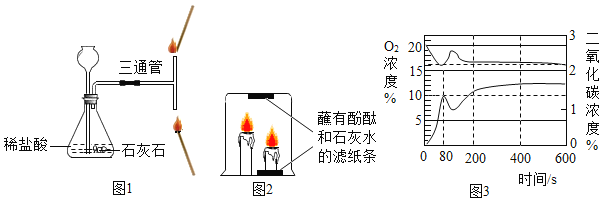
��1��д���������з�����Ӧ�Ļ�ѧ����ʽ___________��
��2����������������X�Ļ�ѧʽ��___________
��3���������о���ת��������¯ʱ�õ������٣������ٵ�������____________��
��4�����������Ƽ���ƵõĴ����п��ܺ���̼�����ơ��Ȼ��Ƶ����ʣ���ѧ��ȤС���ijƷ�ƴ�����Ʒ�ijɷּ�����������ʵ��̽��
������ʵ�飩̽����Ʒ�ijɷ�
ʵ�鲽�� | ʵ������ | ʵ�����. |
_______ | _______ | ��Ʒ�в���̼������ |
_______ | _______ | ��Ʒ�к����Ȼ��� |
������ʵ�飩������Ʒ��ϡ���ᷴӦ���ⶨNa2CO3������������ʵ��װ�ã�����̨��ȥ������ͼ��ʾ����װ�����������ã���������Ļӷ�����ÿ����Ӧ�����ö�����ȫ�ģ���
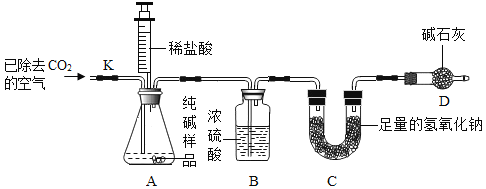
ʵ�鲽�裺
1���װ�õ������ԣ���6g������Ʒ������ƿ��
2������ӦǰCװ������Ϊ50g
3��װװ�ã���ע������A�м���50mLϡ����ʱ��A�в��ٲ������ݡ�
4��ֹˮ��K��ͨ���ѳ�ȥCO2�Ŀ�����һ��ʱ���ر�ֹˮ��
5����װ��C��Ӧ�������Ϊ52.2g
��5�������۷���������4��������______________��ȱ��װ��B������ʹ�ⶨ���____________��ѡ����ƫ��������ƫС��������������.
�ڸ������е����ݼ��㴿����Ʒ��̼���Ƶ���������Ϊ____________����������ȷ��0.1%����
���𰸡�![]() CO2 ���� ȡ��Ʒ���Թ��ڼ��ȣ�������������ͨ������ʯ��ˮ ʯ��ˮ������� ��ȡ��Ʒ���Թ��У��������ϡ���ᣬ���ټ�����������Һ �������ݲ������ڲ�����ɫ���� ʹװ���ڲ����Ķ�����̼���ܱ����գ����ž�װ���ڵĶ�����̼�� ƫ�� 88.3%
CO2 ���� ȡ��Ʒ���Թ��ڼ��ȣ�������������ͨ������ʯ��ˮ ʯ��ˮ������� ��ȡ��Ʒ���Թ��У��������ϡ���ᣬ���ټ�����������Һ �������ݲ������ڲ�����ɫ���� ʹװ���ڲ����Ķ�����̼���ܱ����գ����ž�װ���ڵĶ�����̼�� ƫ�� 88.3%
��������
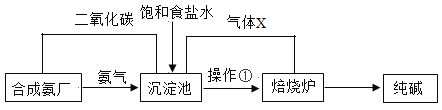
��1���������й����Ķ�����̼�백����ˮ�Լ��Ȼ��Ʒ�Ӧ����̼�����ƺ��Ȼ�淋Ļ�ѧ����ʽ��![]() ��
��
��2������������ʹ�ù����Ķ�����̼���壬����X�Ļ�ѧʽ�ǣ�CO2��
��3���������о���ת��������¯ʱ�õ������Һ�����IJ����٣������ٵ������ǣ����ˣ�
��4������ʵ��һ��ȡ��Ʒ���Թ��ڼ��ȣ�������������ͨ������ʯ��ˮ����ʯ��ˮ������ǣ�˵��û�ж�����̼�������������Ʒ�в���̼�����ƣ�
ʵ�����ȡ��Ʒ���Թ��У��������ϡ���ᣬ�����ݲ������ټ�����������Һ����������ɫ���������������Ȼ��Ʒ�Ӧ�ܲ����Ȼ�����ɫ����������Ʒ�к����Ȼ��ƣ�
��5�������۷���������4�������ǣ��ž�װ���ڵĶ�����̼����ֹ����ʵ�飬ȱ��Ũ����װ��B������ˮ���������Cװ�ã�������������ƫ����ʹ�ⶨ���ƫ��
�ڽ⣺��װ��C�������仯��֪��������̼������Ϊ52.2g-50g=2.2g��
�裺�μӷ�Ӧ̼���Ƶ�����Ϊx��
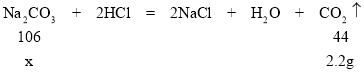
![]() x=5.3g
x=5.3g
������Ʒ��̼���Ƶ���������=![]() ��
��

 ״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д�
״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д�