题目内容
【题目】大气中CO2含量不断升高,使全球气候问题日趋严重。科学家们正在努力尝试通过下列途径减少CO2的排放:利用NaOH溶液来“捕捉”CO2,并将CO2储存或利用,流程如图。
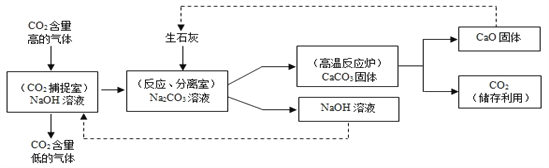
下列有关该过程的叙述正确的是 ( )
该过程可实现CO2零排放
该过程中只有1种物质可以循环利用
C.分离室中分离物质的操作是蒸发
D.该过程至少发生了4个化学反应
【答案】D
【解析】A、由反应的流程图可知,在二氧化碳捕捉室中的氢氧化钠将大部分的二氧化碳吸收掉了,但还有少量的二氧化碳排放到了空气中,错误;B、由反应的流程图可知,氧化钙和氢氧化钠均可循环利用,错误;C、通过分离室分别得到了固体和液体,故分离室中分离物质的操作是过滤,错误;D、该过程反应的反应有:氢氧化钠和二氧化碳反应生成碳酸钠和水、氧化钙与水反应生成氢氧化钙、氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠、高温时碳酸钙分解生成氧化钙和二氧化碳,正确。故选D。

练习册系列答案
相关题目