题目内容
【题目】甲图为几种固体的溶解度曲线,回答下列问题:
![]()
甲 乙
(1)NaCl溶液能够导电,NaCl在水中能够解离出的阳离子是___________(用化学用语表示)
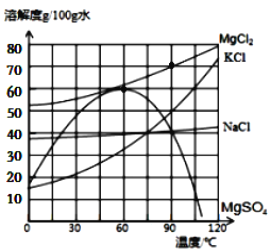
(2)90℃时,MgCl的溶解度是_____,在该温度下配制MgCl溶液,溶质质量分数最大为_________(只列算式,不需要计算结果)。
(3)90℃时,向100g水中加入40gKCl,所得的溶液为___________溶液(填“饱和”或“不饱和”);将上述溶液蒸发掉50g水后恢复到90℃,析出固体的质量是_______g。
(4)如乙图所示,60℃时把试管放入盛有MgSO4的饱和溶液的烧杯中,在试管中加入几小段镁条,再加入5mL稀盐酸,此时观察到的现象有:试管中的镁条和盐酸剧烈反应,产生大量气泡,并立即放出大量的热,同时还观察到烧杯中___________________。
【答案】 Na+ 70g ![]() 或
或 ![]() 不饱和 15 有晶体(固体)析出
不饱和 15 有晶体(固体)析出
【解析】(1)根据溶液导电是因为溶液中含有自由移动的离子分析;
(2)根据溶解度曲线及溶质质量分数解答;
(3)根据溶液是否饱和解答;
(4)根据硫酸镁的溶解度与温度的关系解答。
解:(1)溶液导电是因为溶液中溶质的电离使溶液中存在自由移动的离子。NaCl在水中能够解离出的离子是Na+和Cl-。故NaCl在水中能够解离出的阳离子是Na+;
(2)由图可知90℃时,MgCl的溶解度是70g;饱和溶液溶质质量分数为![]() 。在该温度下配制MgCl溶液,溶质质量分数最大为
。在该温度下配制MgCl溶液,溶质质量分数最大为![]() =
=![]() ;
;
(3)由图可知90℃时KCl的溶解度为50g。故90℃时,向100g水中加入40gKCl,所得的溶液为不饱和溶液。由于90℃时KCl的溶解度为50g,则50g水中溶解KCl的质量为25g。将上述溶液蒸发掉50g水后恢复到90℃,形成KCl的饱和溶液。故析出固体的质量是40g-25g=15g;
(4)由图可知当温度超过60℃时,MgSO4的溶解度随温度的升高而降低。此时若MgSO4溶液是饱和溶液,温度升高则原先溶解的溶质以晶体的形式析出。故填有晶体(固体)析出。

 名校课堂系列答案
名校课堂系列答案