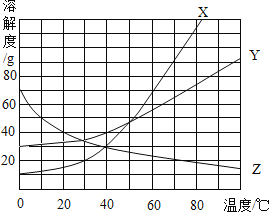
题目内容
【题目】董加亦轩同学配制50 g 6%的氯化钠溶液,整个操作过程如图所示,回答下列问题:
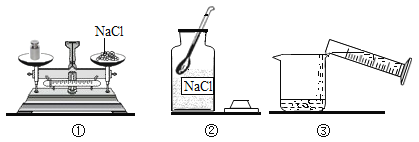
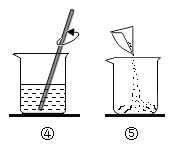
(1)配制溶液的正确操作顺序为_____ (填序号, 下同),其中操作错误的是_____。
(2)图②中盛放氯化钠固体的仪器名称是_____ , 需称取氯化钠_____g。
(3)④中玻璃棒的作用是_____。
(4)量取水时选用的量筒的量程最合适的是_____ (填序号), 读数时视线要与量筒内_____保持水平。
A 10mL
B 25 mL
C 50 mL
D 100 mL
(5)经检测,该同学配制的溶液溶质质量分数偏小,可能的原因是_____ (填序号) 。
A 氯化钠固体不纯
B 用生锈砝码称量
C 装瓶时有少量溶液洒出
D 溶解时烧杯内壁有水珠
(6)预防冠状病毒,除戴口罩外,必要的消毒是必不可少的。中国著名传染病学专家李兰娟院士表示,新型冠状病毒对热敏感,75%的乙醇,含氯的消毒剂都可以有效地灭活病毒。请你根据所学知识配制校园消毒剂,为即将到来的线下开学做好准备。现有500mL96%乙醇溶液,若要配制成75%乙醇溶液,需要加水_____g。 (已知: 96%的乙醇溶液密度为0.79 g/mL)
【答案】②①⑤③④ ① 广口瓶 3.0 搅拌,加速溶解 C 凹液面的最低处 AD 110.6
【解析】
配制50g 6%的氯化钠溶液,则有:
(1)配制溶液的步骤为计算、称量、溶解、装瓶等,如图所示的操作中正确操作顺序为②①⑤③④,其中操作错误的是①,托盘天平使用时,砝码放在右盘,物品放在左盘,图中的物品与砝码的位置放反了。
(2)图②中盛放氯化钠固体的仪器名称是广口瓶,需称取氯化钠![]() 。
。
(3)④溶解的步骤中中玻璃棒的作用是搅拌,加速溶解。
(4)需称取氯化钠3.0g,需要水的质量为50g-3.0g=47.0g,即量取水47mL,选择的量筒的量程要接近于47mL,则选用的量筒的量程最合适的是50 mL,C选项正确,符合题意,故选C;读数时视线要与量筒内凹液面的最低处保持水平。
(5)A、氯化钠固体不纯,溶液中溶质的质量偏小,所得溶液的溶质质量分数偏小,A选项正确,符合题意;
B、用生锈得砝码称重,会造成称取的氯化钠的质量偏大,所得溶液的溶质质量分数偏大,B选项不正确,不符合题意;
C、装瓶时溶液有部分洒出,对所得溶液的溶质质量分数无影响,C选项不正确,不符合题意;
D、溶解时烧杯内壁有少量的水珠,会造成所加水的质量偏大,使所得溶液溶质的质量分数偏小,D选项正确,符合题意。故选AD。
(6)已知96%的乙醇溶液密度为0.79 g/mL,则500mL96%乙醇溶液的质量为![]() ,若要配制成75%乙醇溶液,设需要加水的质量为x,则有
,若要配制成75%乙醇溶液,设需要加水的质量为x,则有![]() ,解得x=110.6g。故需要加水的质量为110.6g。
,解得x=110.6g。故需要加水的质量为110.6g。

 阅读快车系列答案
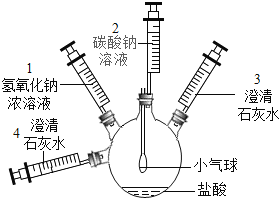
阅读快车系列答案【题目】某实验小组的同学要探究酸碱盐中碳酸钠的化学性质,设计了如下实验装置及方案:
实验装置 | 实验步骤及操作 | 实验现象 |
| ①将注射器2中的溶液推入盛有稀盐酸的瓶中,至不再有气泡产生。 | 气球变瘪 |
②将注射器3稍稍向外拉 | 澄清石灰水变浑浊 | |
③将注射器1中的溶液推入瓶中 | 气球鼓起 | |
④ | 无明显现象 | |
⑤将注射器4中的溶液推入瓶中 |
(一)(1)步骤①中气球变瘪的原因______________________________;
(2)步骤①、②可得出碳酸钠具有________________________________________的性质;
(3)步骤④的操作是________________________,其目的是________________________;
(4)步骤⑤中发生反应的化学方程式__________________________________________;
(5)步骤③④⑤可得出碳酸钠具有________________________________________的性质;
(二)上述实验结束后,实验小组的同学又对瓶内溶液的成分十分好奇,进行了探究:
(1)(提出猜想)通过分析,一致认为瓶内溶液的溶质中一定含有______________________,可能含有氢氧化钙或____________。
(2)(实验验证)设计实验方案确定溶液中溶质的组成.
实验操作 | 实验现象 | 实验结论 |
分别取少量溶液于A、B两支试管中,A中 加入CaCl2溶液,B中加入Na2CO3溶液 | A中产生白色沉淀,B中没有沉淀 | 瓶内溶液中溶质的成分为___________ |
(3)(反思与交流)根据所学化学知识,除了以上方案外,下列哪些物质可以代替试管B中加入的Na2CO3溶液完成该实验?__________(填序号)
a K2CO3 b BaCO3 c CO2 d 无色酚酞 e CuSO4