题目内容
【题目】为了测定某地石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份,进行如下实验:(请写出详细的计算过程)
实验 | 1 | 2 | 3 | 4 |
加入样品的质量(g) | 5 | 10 | 15 | 20 |
生成CO2的质量(g) | 1.76 | 3.52 | 4.4 | 4.4 |
(1)计算这种石灰石样品中碳酸钙的质量分数___.
(2)计算出实验所用稀盐酸中HCl的质量分数___.
【答案】80% 14.6%
【解析】
(1)由1、2、3组数据可知:随样品的加入,二氧化碳不再增多,说明1、2组中的样品已完全反应,由样品完全反应时样品的质量和生成二氧化碳的质量,根据碳酸钙与稀盐酸反应的化学方程式可以计算出样品中碳酸钙的质量分数;
(2)由3、4组数据可知:3、4组中的稀盐酸已完全反应,由稀盐酸完全反应时生成二氧化碳的质量和稀盐酸的质量,根据碳酸钙与稀盐酸反应的化学方程式可以计算出稀盐酸中溶质的质量分数。
解:(1)设样品中碳酸钙的质量分数为x,
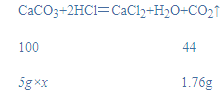
![]()
x=80%;
(2)稀盐酸中溶质的质量分数为y,
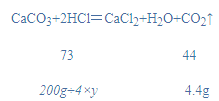
![]()
y=14.6%。

练习册系列答案
相关题目