题目内容
【题目】化学与生活密切相关。
I.水和水溶液是人类必不可少的宝贵资源。
(1)科学家对水的生成和分解实验的研究,确认水是由______和______组成的。
(2)自然界中的水都不是纯水,利用沉淀、_______、吸附和蒸馏等方法可以净化水。
(3)生活中简便区别硬水和软水的方法是_____________________________。
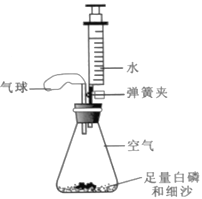
(4)水能灭火,但有时水也可以“生火”。比如将过氧化钠(Na2O2)用脱脂棉包裹,再往上面滴加水,脱脂棉一会儿就会发生燃烧。该过程发生了如下反应2Na2O2 + 2H2O=4NaOH +X↑。
①X的化学式是__________。
②滴加水后,脱脂棉能燃烧的原因是_____________________________。
II.黑木耳是一种含铁丰富的食用菌。
①黑木耳中所含的“铁”是指______(填“分子”“原子”或“元素”)。
②常吃黑木耳能有效预防人体缺铁而引发的疾病是__________。
③黑木耳中的铁可以用KSCN溶液与铁离子作用生成Fe(SCN)3来检测。在Fe(SCN)3中C、N的化合价分别是+4、-3,则S的化合价是_______;Fe(SCN)3中铁元素的质量分数为
______(列出计算式即可)。
【答案】H O 过滤 使用肥皂水 O2 过氧化钠和水反应有氧气产生可以助燃,生成的氢氧化钠和多余的水可以产生热量使得脱脂棉燃烧; 元素 贫血病 -2 ![]()
【解析】
(1)水是由氢元素和氧元素组成的;
(2)常利用沉淀、过滤、吸附和蒸馏等方法净化水;
(3)生活中可以利用肥皂水区分软水和硬水;
(4)①根据原子守恒X的化学式为O2;
②过氧化钠和水反应有氧气产生可以助燃,生成的氢氧化钠和多余的水可以产生热量使得脱脂棉燃烧;
Ⅱ①食物中的营养都是指元素;
②缺铁可引起人体得贫血病;
③根据化合价之和为零计算设S为X价则:X+4-3=-1 X=-2,铁的质量分数=![]()

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】某化学兴趣小组的同学为了测定石灰石中碳酸钙的质量分数,称取了5份石灰石样品(杂质不与稀盐酸反应),分别加入过量的稀盐酸进行实验,结果如下:
实验 | 1 | 2 | 3 | 4 | 5 |
石灰石样品的质量/g | 1.25 | 2.50 | 5.00 | 6.25 | 7.50 |
生成CO2的质量/g | 0.44 | 0.88 | 1.66 | 2.20 | 2.64 |
分析上述实验数据并回答:
(1)第______次实验数据有明显错误,理由是________________;
(2)计算这种石灰石样品中碳酸钙的质量分数______。