题目内容
某同学为了测定由氧化铜和氧化铁组成的混合物中各成分的质量分数,用氢气作还原剂,并用浓硫酸吸收反应生成的水.已知混合物的总质量是24g,实验前盛有浓硫酸的试管的总质量是130.5g,实验后变为137.7g(设反应已进行完全,且生成的水全部被浓硫酸吸收),据此计算:(1)参加反应的氢气的质量是多少?(2)混合物中氧化铜的质量分数是多少?
解:(1)浓硫酸吸收的水分的质量为:137.7g-130.5g=7.2g,根据质量守恒定律可知,浓硫酸吸收的水分中的氢气就是参加反应的氢气,其质量为: =0.8g;
=0.8g;
(2)设质量为x的氧化铜参与反应生成水的质量为y,(24-x)g氧化铁参与反应生成水的质量为z,生成的水分的质量总和z+y应为7.2g
H2+CuO Cu+H2O
Cu+H2O
80 18
x y
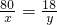 y=
y=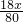
3H2+Fe2O3 2Fe+3H2O
2Fe+3H2O
160 54
24-x z
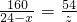 z=
z=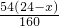
z+y=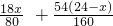 =7.2
=7.2
解之得:x=8g
混合物中氧化铜的质量分数为: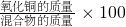 %=
%= %=33.3%
%=33.3%
故答案为:
(1)0.8克;
(2)33.3%.
分析:(1)根据质量守恒定律可知,浓硫酸吸收的水分中的氢气就是参加反应的氢气来计算;
(2)根据反应生成水的质量可以推算出氧化铜的质量,再根据质量分数的公式计算出混合物中氧化铜的质量分数;
点评:本题考查化学方程式的计算,要熟记和理解氢气还原氧化铜、氧化铁的化学反应方程式、认真地进行解答即可.
 =0.8g;
=0.8g;(2)设质量为x的氧化铜参与反应生成水的质量为y,(24-x)g氧化铁参与反应生成水的质量为z,生成的水分的质量总和z+y应为7.2g
H2+CuO
 Cu+H2O
Cu+H2O80 18
x y
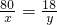 y=
y=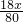
3H2+Fe2O3
 2Fe+3H2O
2Fe+3H2O160 54
24-x z
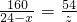 z=
z=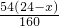
z+y=
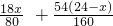 =7.2
=7.2解之得:x=8g
混合物中氧化铜的质量分数为:
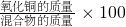 %=
%= %=33.3%
%=33.3%故答案为:
(1)0.8克;
(2)33.3%.
分析:(1)根据质量守恒定律可知,浓硫酸吸收的水分中的氢气就是参加反应的氢气来计算;
(2)根据反应生成水的质量可以推算出氧化铜的质量,再根据质量分数的公式计算出混合物中氧化铜的质量分数;
点评:本题考查化学方程式的计算,要熟记和理解氢气还原氧化铜、氧化铁的化学反应方程式、认真地进行解答即可.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某化学兴趣小组同学为了测定蜡烛中碳、氢两种元素的质量比,设计了如图所示的实验.实验步骤如下:先称量蜡烛、装置Ⅱ和装置Ⅲ的质量.按图示连接装置,点燃蜡烛,一段时间后蜡烛熄灭,再分别称量蜡烛、装置Ⅱ和装置Ⅲ的质量.实验数据如下表:

请根据上图装置和数据回答问题:
(1)装置Ⅱ中浓硫酸的作用是 ,
装置Ⅲ中氢氧化钠和氧化钙固体的作用是 .
(2)从上表数据可知,反应后生成水 克,二氧化碳 克.
(3)由该实验数据计算,蜡烛中碳元素和氢元素的质量比为 .
(4)装置Ⅱ和装置Ⅲ能否对调? (填“能”或“不能”),原因是 .
(5)该小组同学发现装置Ⅱ和装置Ⅲ增加的总质量大于蜡烛减少的质量,请你用所学过的知识解释他们的疑惑: .

| 蜡烛 | 装置Ⅱ | 装置Ⅲ | |
| 反应前的质量/g | 15.8 | 182.3 | 212.2 |
| 反应后的质量/g | 14.4 | 184.1 | 216.6 |
(1)装置Ⅱ中浓硫酸的作用是
装置Ⅲ中氢氧化钠和氧化钙固体的作用是
(2)从上表数据可知,反应后生成水
(3)由该实验数据计算,蜡烛中碳元素和氢元素的质量比为
(4)装置Ⅱ和装置Ⅲ能否对调?
(5)该小组同学发现装置Ⅱ和装置Ⅲ增加的总质量大于蜡烛减少的质量,请你用所学过的知识解释他们的疑惑:
(2007?嘉定区二模)某化学兴趣小组同学为了测定蜡烛中碳、氢两种元素的质量比,设计了如图所示的实验.实验步骤如下:先称量蜡烛、装置Ⅱ和装置Ⅲ的质量.按图示连接装置,点燃蜡烛,一段时间后蜡烛熄灭,再分别称量蜡烛、装置Ⅱ和装置Ⅲ的质量.实验数据如下表:

请根据上图装置和数据回答问题:
(1)装置Ⅱ中浓硫酸的作用是______,
装置Ⅲ中氢氧化钠和氧化钙固体的作用是______.
(2)从上表数据可知,反应后生成水______克,二氧化碳______克.
(3)由该实验数据计算,蜡烛中碳元素和氢元素的质量比为______.
(4)装置Ⅱ和装置Ⅲ能否对调?______(填“能”或“不能”),原因是______.
(5)该小组同学发现装置Ⅱ和装置Ⅲ增加的总质量大于蜡烛减少的质量,请你用所学过的知识解释他们的疑惑:______.

| 蜡烛 | 装置Ⅱ | 装置Ⅲ | |
| 反应前的质量/g | 15.8 | 182.3 | 212.2 |
| 反应后的质量/g | 14.4 | 184.1 | 216.6 |
(1)装置Ⅱ中浓硫酸的作用是______,
装置Ⅲ中氢氧化钠和氧化钙固体的作用是______.
(2)从上表数据可知,反应后生成水______克,二氧化碳______克.
(3)由该实验数据计算,蜡烛中碳元素和氢元素的质量比为______.
(4)装置Ⅱ和装置Ⅲ能否对调?______(填“能”或“不能”),原因是______.
(5)该小组同学发现装置Ⅱ和装置Ⅲ增加的总质量大于蜡烛减少的质量,请你用所学过的知识解释他们的疑惑:______.