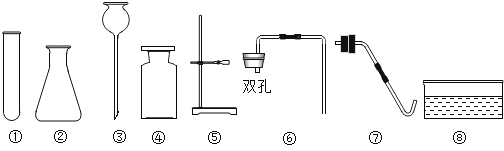
题目内容
【题目】实验室有一瓶含有Na2SO4和Na2CO3的混合溶液,某化学兴趣小组设计实验来测定溶液的质量分数。他们经过讨论后设计了如下图一装置进行实验探究:
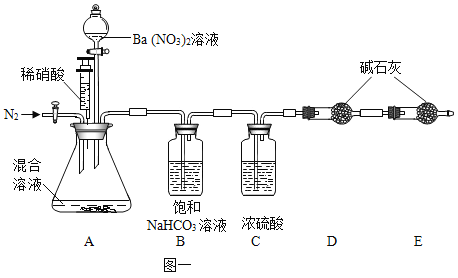
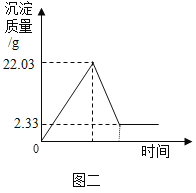
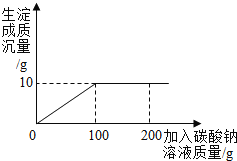
实验过程中,向100g混合液先加入Ba(NO3)2溶液,再加稀硝酸,得沉淀变化趋势如图二、请你根据题意回答问题:
(1)22.03g沉淀中含有什么物质?_____(填化学式)。针筒注入稀硝酸产生气体的化学方程式为_____。
(2)求原混合液中Na2SO4的质量分数。_____(写出过程)
【答案】BaSO4、BaCO3 BaCO3+2HNO3=Ba(NO3)2+CO2↑+H2O 1.42%
【解析】
(1)根据硝酸钡溶液和碳酸钠溶液反应生成碳酸钡沉淀和硝酸钠,反应的化学方程式为:Na2CO3+Ba(NO3)2=BaCO3↓+2NaNO3;硝酸钡溶液和硫酸钠溶液反应生成硫酸钡沉淀和硝酸钠,Na2SO4+Ba(NO3)2=BaSO4↓+2NaNO3,所以22.03g沉淀中含有碳酸钡和硫酸钡;硝酸和碳酸钡反应生成硝酸钡、水和二氧化碳,反应的化学方程式为:BaCO3+2HNO3=Ba(NO3)2+H2O+CO2↑;
(2)硫酸钡不溶于稀硝酸,所以由图2可知2.33g沉淀就是生成的硫酸钡沉淀,设原混合液中Na2SO4的质量为x,

![]()
x=1.42g,
原混合液中Na2SO4的质量分数=![]() ×100%=1.42%;
×100%=1.42%;
答:原混合液中Na2SO4的质量分数为1.42%。

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案【题目】教育部从2018年开始,要求在学校普及垃圾分类回收处理的相关知识。某化学活动小组结合所学的知识对此进行一系列实践活动。
I活动探究
(1)学会识图分拣垃圾:下列垃圾应投入带有如图图标的垃圾箱内的是____ (填字母)。

A塑料瓶 B果皮 C碎瓷片
(2)学会检验有害气体:含氯塑料焚烧时会产生氯化氢等气体。
若要检验焚烧后的气体中有氯化氢,可将其通入加有稀硝酸的___________溶液中,有白色沉淀生成即可,反应的化学方程式为______________,反应的基本类型是_________________。
II.实验探究
[提出问题]如何回收处理废旧电池中的铬?
[查阅资料](1)废旧电池中含有镉、汞等元素,这些元素会危害人类健康。
(2)镉(Cd)从溶液中析出时呈海绵状固体。在化合物中通常表现为+2价。
(3)碳酸镉(CdCO3)、氢氧化镉[Cd(OH)2]都是白色固体。难溶于水。
[设计实验]同学们先将废旧电池进行处理以制得硫酸镉(CdSO4)溶液,然后设计了三种不同方案进行回收镉。
实验设计 | 实验步骤 | 实验现象 | 实验结论 |
与金属反应 | 取少许溶液于试管中,加入足量的Zn粉,充分反应 | ____________ | Zn可以置换出Cd |
与碱反应 | 取少许溶液于试管中,加入足量的NaOH溶液, 充分反应 | 产生白色沉淀 | 该反应的化学方程 式______ |
与盐反应 | 取少许溶液于试管中,加入足量的______溶液,充分反应 | 产生白色沉淀 | 可用该试剂沉淀Cd2+ |
[回收处理]实验结束后,将反应后的混合物通过过滤,洗涤、加热,进而再制得镉。
[交流反思]请同学们基于化学视角说明垃圾分类回收处理的重要意义____________(各一点即可)。