题目内容
【题目】金属材料在生产、生活中有广泛的应用,认识金属的性质有利于更好地利用金属。
(1)铁在初中化学实验中多次亮相,如图展示了铁钉的一系列变化。
![]()
I.变化①是铁钉与空气中的____________发生了反应。
II.变化②中常见除去铁锈的化学方程式为_______________。
III.如图是小明同学记录的锌粉与稀硫酸反应过程中反应时间与产生气体体积的变化数据:
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 50 | 120 | 230 | 290 | 310 |
实验数据反映,该反应速率的特点是_________,引起该速率变化的原因是__________。
(2)将m克锌和铁的混合物放入硝酸铜溶液中,充分反应,经过滤、洗涤、干燥后,固体仍为m克,则反应后滤液中一定含有的溶质是____________(填化学式)。
【答案】O2、H2O ![]() 先增大后减小 金属与酸反应放热,随着反应进行溶液的温度升高,反应速度加快,第4分钟以后,盐酸的浓度越来越小,所以反应速率逐渐减小; Zn(NO3)2、Fe(NO3)2
先增大后减小 金属与酸反应放热,随着反应进行溶液的温度升高,反应速度加快,第4分钟以后,盐酸的浓度越来越小,所以反应速率逐渐减小; Zn(NO3)2、Fe(NO3)2
【解析】
(1)I.铁生锈是铁与空气中的氧气、水固体作用的结果,所以铁钉锈蚀,是因为铁与空气中的O2、H2O等发生了反应。
II.铁锈的主要成分是氧化铁,铁锈和盐酸反应能生成氯化铁和水,化学方程式为:![]() 。
。
III.分析表中数据,产生气体体积的变化:第1分钟50mL,第2分钟70mL,第3分钟110mL,第4分钟60mL,第5分钟20mL;原因是金属与酸反应放热,随着反应进行溶液的温度升高,反应速度加快,第4分钟以后,盐酸的浓度越来越小,所以反应速率逐渐减小。
(2)将m克锌和铁的混合物放入硝酸铜溶液中,充分反应,经过滤、洗涤、干燥后,固体仍为m克,说明锌和铁都与硝酸铜溶液发生了反应,则反应后滤液中一定含有的溶质是Zn(NO3)2、Fe(NO3)2。

【题目】化学教材 “寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣。
(提出问题)(1)氧化铁能否作过氧化氢溶液分解的催化剂?
(2)氧化铁与二氧化锰催化效果哪个好?
(3)催化剂的质量是否对过氧化氢溶液分解的速率产生影响?
(实验探究)
实验步骤 | 实验现象 |
①分别量取5 mL5%过氧化氢溶液放入A、B 两支试管中,向A试管中加入a g氧化铁粉末,并分别在A、B两支试管中插入带火星的木条,观察现象。 | A试管中产生大量气泡,带火星木条复燃,B试管中的现象: |
②待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管内,如此反复多次实验,观察现象。 | 试管中均产生大量气泡,带火星木条均复燃 |
③将实验②中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为a g。 | |
④分别量取5 mL5%过氧化氢溶液放入C、D 两支试管中,向C试管中加入a g氧化铁粉末,向D试管中加入a g二氧化锰粉末,观察现象。 |
|
(1)A中产生的气体是 _________;B试管中的现象___________。
(2)实验②、③证明:氧化铁的 ______ 和 _____ 在反应前后均没有发生变化,可以作过氧化氢分解的催化剂;
(3)实验设计④的目的是_________ ,若实验④观察到D试管中产生气泡的速率更快,由此你可以得到的结论是 ________ 。
(4)兴趣小组同学设计了如下图实验装置,利用压强传感器测不同质量二氧化锰对双氧水分解快慢的影响。在8mL3%的双氧水中分别加入了0.08g,0.12g,0.24gMnO2.测得容器内压强的变化曲线如下右图所示(曲线的斜率表征催化反应的速率)。请观察图,回答问题:
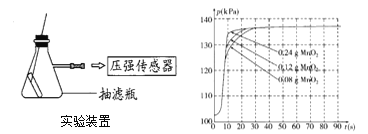
(Ⅰ)根据图1可发现:该实验条件下,30s内催化分解8mL浓度为3%的双氧水,MnO2的最小用量为___克。
(Ⅱ)根据图1,下列说法正确的是________。
a.一定范围内,二氧化锰用量越多,双氧水分解越快;
b.反应容器的气密性,对实验所测数据的精确度有影响;
c.称量的二氧化锰质量的精确度对实验装置中最终的压强大小没有影响。