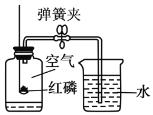
题目内容
【题目】向100g硫酸铜与硫酸的混合溶液中加入溶质质量分数为10%的氢氧化钠溶液,溶液质量与所加氢氧化钠溶液的质量关系如图所示,回答下列问题:
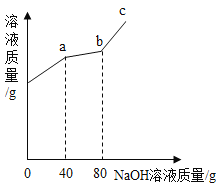
(1)由图像可知,c点溶液中的溶质是_____________。
(2)当加入氢氧化钠溶液的质量为80g时,所得不饱和溶液中溶质的质量分数是__________?(结果精确到0.1%)
【答案】氢氧化钠、硫酸钠 8.1%
【解析】
由图像可知,a点硫酸和氢氧化钠恰好反应,b点硫酸铜和氢氧化钠恰好反应,c点为氢氧化钠过量。
(1)由于c中氢氧化钠过量,则溶质为氢氧化钠、硫酸钠。
(2)当加入氢氧化钠溶液的质量为80g时,所得不饱和溶液中溶质为两个反应产生的硫酸钠,氢氧化钠溶质的质量=![]()
设反应生成的硫酸钠为x
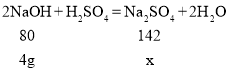
![]()
解得x=7.1g
设反应生成的硫酸钠为y。

![]()
![]()
解得y=7.1g z=4.9g
溶液中溶质的质量分数=![]()
答:不饱和溶液中溶质的质量分数是8.1%。

练习册系列答案
相关题目
【题目】金属材料在生产、生活中有广泛的应用,认识金属的性质有利于更好地利用金属。
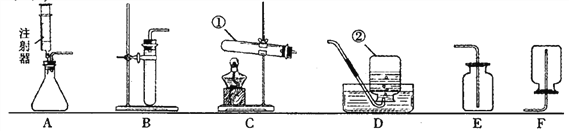
(1)铁在初中化学实验中多次亮相,如图展示了铁钉的一系列变化。
![]()
I.变化①是铁钉与空气中的____________发生了反应。
II.变化②中常见除去铁锈的化学方程式为_______________。
III.如图是小明同学记录的锌粉与稀硫酸反应过程中反应时间与产生气体体积的变化数据:
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 50 | 120 | 230 | 290 | 310 |
实验数据反映,该反应速率的特点是_________,引起该速率变化的原因是__________。
(2)将m克锌和铁的混合物放入硝酸铜溶液中,充分反应,经过滤、洗涤、干燥后,固体仍为m克,则反应后滤液中一定含有的溶质是____________(填化学式)。